Как в фотошопе отменить несколько последних действий. Как отменить действие в «Фотошопе CS6»: три простых способа
Как применять горячие клавиши в фотошопе для отмены действия
Как отменить действие в фотошопе cs6 или cs5? Одна из самых главных и полезных функций Photoshop – возврат действия на клавиатуре, которая позволяет сделать шаг назад при обработке. Это можно осуществить несколькими способами, но самым простым остается сочетание горячих клавиш. С их помощью можно аннулировать изменение, которое внесли в программе, нужно запомнить простую комбинацию клавиш – Ctrl+Z. Если нажать ее повторно, то отмененные изменения вернутся обратно.
- Куриный суп: вкусные рецепты с фото
- Как мариновать лук — рецепты с фото. Как вкусно замариновать лук для салата, рыбы или мяса
- У собаки урчит в животе что делать
Пакетная обработка:
Часто возникает необходимость обработать много однотипных изображений. Нет смысла обрабатывать каждое в отдельности, гораздо лучше сделать это пакетом: задать папку с исходными изображениями, указать набор операций и папку, куда сохранять результаты обработки.
Последовательность действий такая:
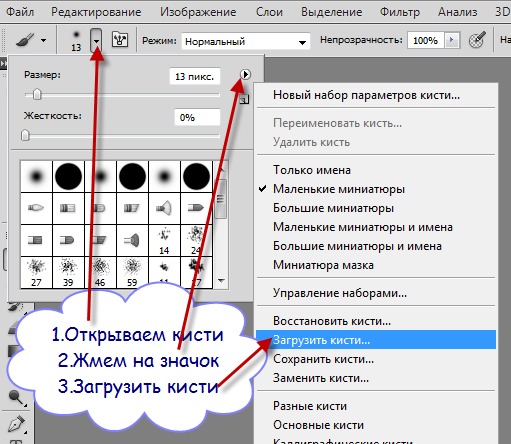
1. File — Automate (Автоматически)- Batch (Пакет) 2. в списке Set (Набор) указывают название набора операций которые надо выполнить со всеми изображениями. В списке Action указывают название операции. В списке Source(Источник) выберите Folder (папка) 3. Нажмите кнопку Shoose. Выберите папку в которой находятся изображения, с которыми будете работать. 4. отметьте Override Action «Open» Commands. Если эта галочка не стоит, то будет использоваться папка указанная в операции, а не та, которую указали выше. 5. В списке Destination выберите Folder. Ниже нажмите на кнопку Choose и укажите папку для сохранения готовых изображений. Включите галочку ниже, чтоб использовалась именно эта папка. 6. Создаваемые в результате выполнения операций изображения должны иметь свои имена. Для них можно задать правила в группе File Naming.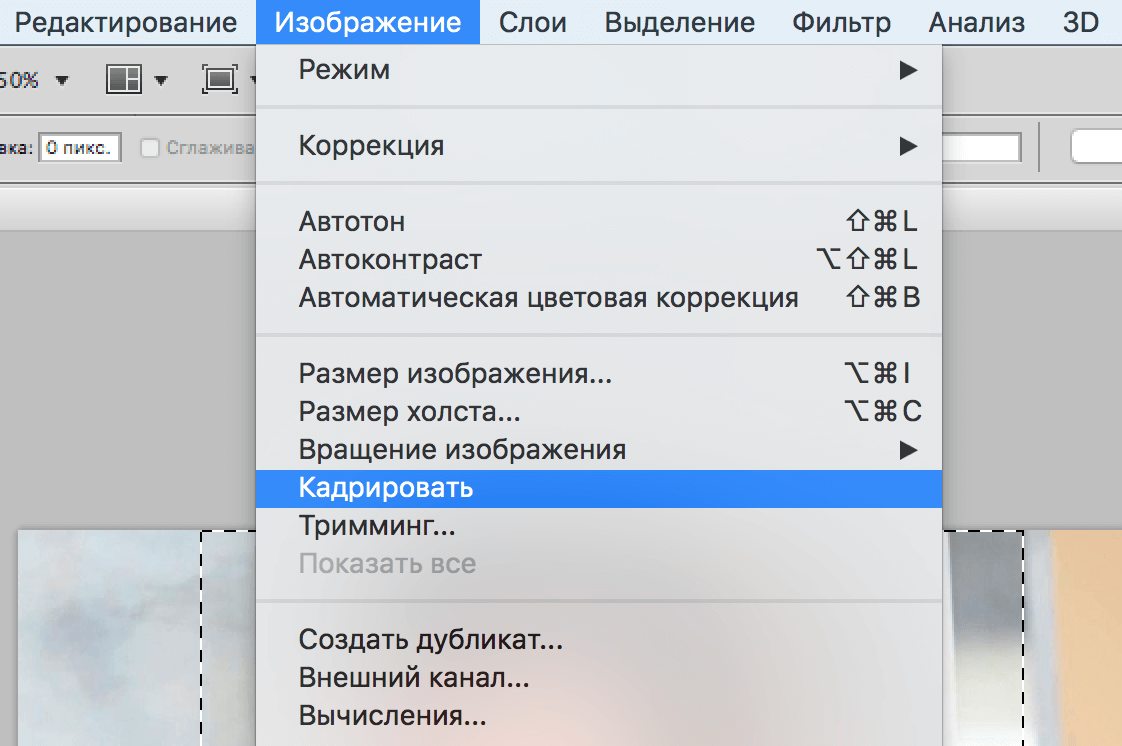 Здесь есть имя документа, расширение, дата создания, порядковый номер и т.д. в Document Name введите имя, вextension — расширение. Нажмите O»K.
Здесь есть имя документа, расширение, дата создания, порядковый номер и т.д. в Document Name введите имя, вextension — расширение. Нажмите O»K.
Ошибочное действие
в документе, созданном в MS Word, в меню «Правка» выберите команду «Отменить». Этого же результата можно добиться, используя горячие клавиши Alt+Backspace. Если вы вдруг поняли, что
действие
было правильным, и зря вы его отменяли, примените сочетание Ctrl+Y.
На панели быстрого доступа найдите кнопку «Отменить». Если требуется отменить сразу несколько действий, нажмите на стрелку вниз рядом с этой кнопкой, чтобы раскрыть список последних совершенных действий. При зажатой левой клавише мыши отметьте курсором ненужные операции и отпустите клавишу. Этого же результата можно добиться, используя сочетание клавиш Ctrl+Alt+Z.
Рядом с «Отменить» на панели быстрого доступа находится кнопка «Вернуть». Она возвращает удаленные шаги. Ее действие
дублируется функциональной клавишей F4. Если кнопка «Отменить» не использовалась, «Вернуть» будет недоступна.
Для отмены действий в MS Excel также используется команда «Отменить» из меню правка, кнопка «Отменить» на панели быстрого доступа и сочетания клавиш Alt+Backspace и Ctrl+Z. Для возвращения ошибочно отмененных действий применяются те же средства, что и в MS Word.
В Adobe Photoshop в этой ситуации удобно использовать горячие клавиши Ctrl+Alt+Z и команду Step Backward («Шаг назад») из меню Edit («Редактирование»). Для возвращения ошибочно отмененного действия примените команду Step Forward («Шаг вперед») и сочетание Shift+Ctrl+Z.
Кроме стандартных клавиш и команд, в Photoshop есть удобная опция History («История»). Найдите ее в меню Window («Окно») и отметьте галочкой. Найдите на панели History ненужное действие
, подцепите его мышкой и перетащите на значок корзины в нижней части панели. Чтобы отменить все изменения, щелкните по иконке изображения в самом верху списка.
Если вы произвели какие-то фатальные изменения в операционной системе, вернуть ее работоспособность вам поможет служба «Восстановление системы». Вызовите окно запуска программ сочетанием Win+R и введите в строку «Открыть» команду msconfig. Перейдите во вкладку «Сервис», о и нажмите «Запустить». Выберите дату, наиболее близкую к той, когда были произведены ошибочные действия.
Вызовите окно запуска программ сочетанием Win+R и введите в строку «Открыть» команду msconfig. Перейдите во вкладку «Сервис», о и нажмите «Запустить». Выберите дату, наиболее близкую к той, когда были произведены ошибочные действия.
Источники:
- как вернуть действие назад
При работе в приложениях, редактирующих те или иные файлы, автоматически сохраняется определенное количество предыдущих шагов изменений файла. В некоторых случаях история сохраняется полностью, в других – только ее часть. Практически везде доступна функция восстановления первоначального состояния, однако при условии, что файл не сохранялся в процессе обработки.
Инструкция
Если вам нужно отменить последние , связанные с вводом и форматированием текста в редакторе, окне браузера и проч., для этого просто нажмите сочетание клавиш Ctrl+Z. Также в текстовом редакторе MS Office Word имеется специальная кнопка на панели инструментов, отвечающая за отмену последних изменений. Еще возможен вариант использования меню «Правка», «Отменить». В данном случае если ранее было произведено сохранение процесса редактирования документов, возврат на предыдущую позицию возможен.
Если вам нужно отменить последние изменения, связанные с редактированием изображений в программе Adobe Photoshop, воспользуйтесь сочетанием клавиш Alt+Ctrl+Z или нажмите на пункт меню «Редактирование», затем в выпадающем меню выберите «Шаг назад».
Если хотите полностью восстановить файл, нажмите F12. Если вы уже сохранили изменения, тогда их отмена будет невозможна. При редактировании графических файлов вообще лучше всего создавать и редактировать их копии, а оригиналы хранить отдельно. Также просмотрите историю изменений в специальной таблице изменений, которая доступно из пункта меню «Окно».
Если вы хотите отменить последние изменения, которые повлияли на работу компьютера (например, установка обновлений, программ, утилит), откройте меню «Пуск», выберите меню стандартных программ, затем «Служебные» и, наконец, «Восстановление системы».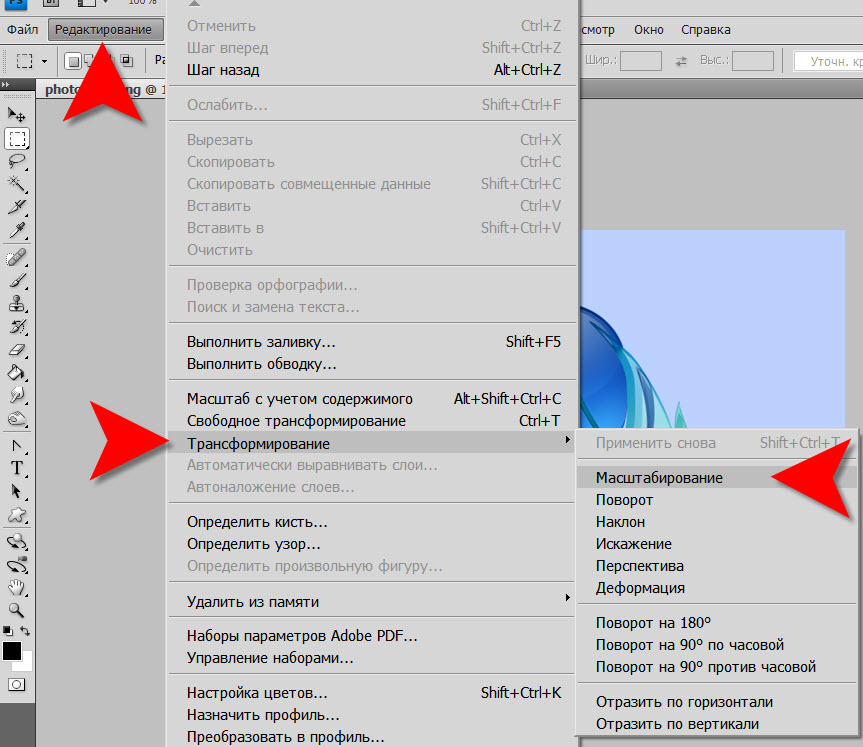 Перед вами на экране появится большое окно восстановления операционной системы, выберите на календаре программы контрольную точку сохранения параметров до произведения изменений в системе, выполните откат до этой даты.
Перед вами на экране появится большое окно восстановления операционной системы, выберите на календаре программы контрольную точку сохранения параметров до произведения изменений в системе, выполните откат до этой даты.
Имейте в виду, что перед этим лучше всего сохранить личные данные, используемые вами при работе в приложениях, установленных за этот период, поскольку программы будут удалены вместе с ними. Это могут быть различные логины и пароли учетных записей, файлы ключей, ссылки и так далее.
Источники:
- как быть если тебе измении
При работе с изображениями в «Фотошопе
» может потребоваться отменить предыдущее
действие
и вернуться к исходной картинке. Для возвращения к предыдущему результату нужно выполнить несколько действий..
Вам понадобится
- — компьютер;
- — любая версия программы «Фотошоп».
Инструкция
Работа с изображениями – увлекательное занятие, которое требует от фотомастера определенных знаний и умений. Но даже у опытного пользователя «Фотошопа» нередко возникают ситуации, когда в ходе работы над созданием нового шедевра нужно вернуться на несколько шагов назад.
Внести изменения в обрабатываемое фото можно на любом этапе редактирования. Правда, пред началом работы вам, естественно, нужно открыть изображение. Для этого достаточно одновременно нажать клавиши клавиатуры Alt+Shift+Ctr+O или в меню «Файл», что на рабочей панели, выбрать опцию «Открыть как», после чего указать место расположения изображения и его формат.
Далее приступайте к непосредственной обработке. А если потребуется внести изменения и вернуться назад, загляните в раздел «Редактирование» на рабочей панели. Здесь вы сможете произвести необходимые операции, выбрав соответствующую опцию: «О и «Шаг назад».
Для удобства вы можете воспользоваться «горячими клавишами»: Ctrl+Z – для отмены последнего действия, Shift+Ctrl+Z — для совершения шага вперед и Alt+Ctrl+Z – для выполнения шага назад.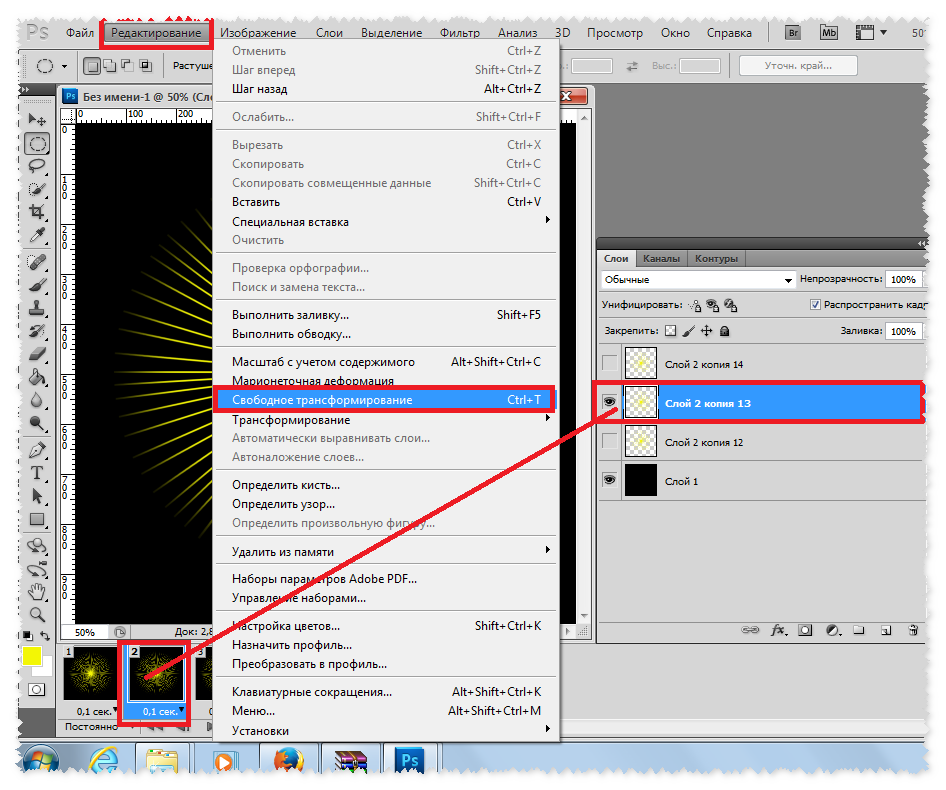
Просмотреть всю историю изменений изображения в «Фотошопе
» также можно, выбрав соответствующую операцию в меню «Окно» верхней панели. Отметьте галочкой пункт «История» в данном разделе, и в рабочем окне появится таблица, демонстрирующая все выполненные с картинкой действия.
Для отмены совершенных изменений на каком-либо этапе обработки изображения достаточно на экране «История» найти нужную операцию и вернуться к ней, кликнув по ней левой кнопкой мыши. В данном случае вы окажетесь именно на том шаге редактирования, на который укажете.
Если же вам нужно сохранить на фотографии все ранее произведенные действия, оставьте для себя черновой вариант изображения. Ведь он вам может еще понадобиться. А чтобы не запутаться , при сохранении придумайте ей название, по которому вы легко сориентируетесь во всех своих фотографиях, законченных и находящихся пока на стадии обработки.
Процедура отмены и удаления установленных обновлений операционной системы Microsoft Windows представляет из себя стандартную операцию, не требующую привлечения дополнительного программного обеспечения.
Инструкция
Вызовите главное системное меню, нажав кнопку «Пуск», и перейдите в пункт «Панель управления». Раскройте ссылку «Программы» и разверните узел «Просмотр установленных обновлений» в разделе «Программы и компоненты». Найдите подлежащее удалению обновление в списке открывшегося диалогового окна и вызовите его контекстное меню кликом правой кнопки мыши. Укажите команду «Удалить» и нажмите кнопку «Да» в открывшемся окошке запроса системы. Дождитесь завершения процесса.
Если речь идет об обновлении SP3 для Windows XP, воспользуйтесь возможностью удаления в скрытой системной папке $NTServicePackUninstall$. Для этого вернитесь в главное меню «Пуск» и перейдите в диалог «Выполнить». Напечатайте имя_диска:\windows\$NTServicePackUninstall$\spuninst.exe в строке «Открыть» и запуск утилиты мастера удаления пакета обновления, нажав кнопку OK. Подтвердите выполнение выбранного действия, нажав кнопку «Далее» в главном окне мастера и выполните все его рекомендации.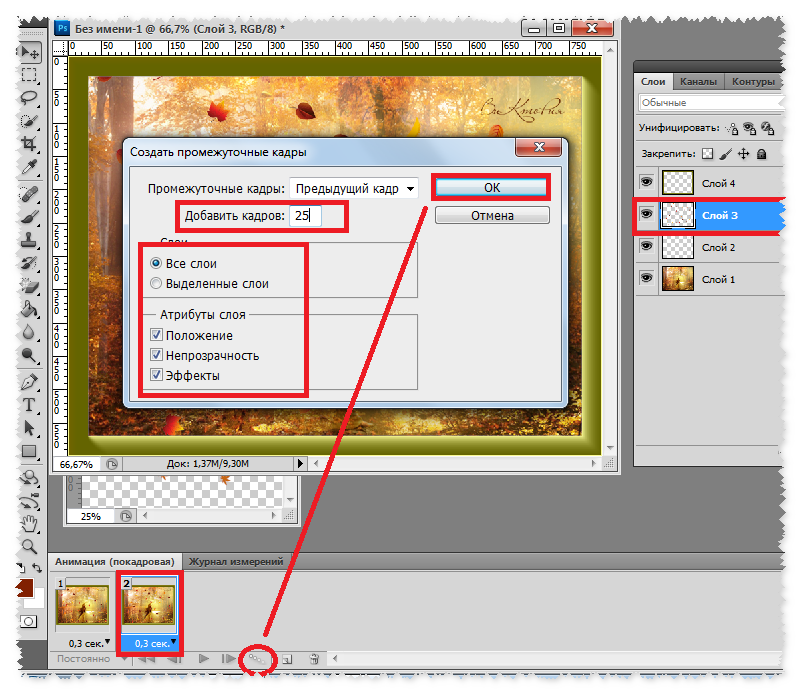
Одним из наиболее распространенных способов отмены установленного обновления можно считать использование функции восстановления прежнего состояния системы. Для применения данного способа удостоверьтесь в том, что компьютер был перезагружен хотя бы один раз после установки обновления и вызовите главное системное меню, нажав кнопку «Пуск». Перейдите в диалог «Выполнить» и напечатайте %systemroot%\System32\restore\rstrui.exe в строке «Открыть». Подтвердите запуск утилиты, нажав кнопку OK, и укажите опцию «Восстановление более раннего состояния компьютера» в открывшемся диалоговом окне. Подтвердите выполнение выбранного действия, нажав кнопку «Далее», и выберите желаемую дату для отката системы. Сохраните сделанные изменения, нажав кнопку «Далее» и выполните все рекомендации мастера восстановления. Перезагрузите компьютер для применения сделанных изменений.
Источники:
- Удаление пакета обновления SP3 для Windows XP
- как отменить установленные обновления
Редактор Adobe Photoshop является мощным инструментом обработки цифровых изображений. Это средство для решения профессиональных задач. Вследствие ориентированности на профессиональную среду, Photoshop не славится простотой. Поэтому у новичков, использующих Photoshop, возникает масса вопросов. Один из первых, пожалуй, будет о том, как отменить в фотошопе
сделанные изменения.
Вам понадобится
- Графический редактор Adobe Photoshop.
Инструкция
Отмените последнее совершенное действие
. Для этого выберите в главном меню приложения пункт «Edit». В раскрывшемся выпадающем меню кликните на пункт, название которого начинается со «Undo». Название данного пункта из слова «Undo» со следующим за ним названием последнего примененного инструмента или совершенного действия. Поэтому всегда можно видеть, какая операция будет отменена. Вместо выбора указанного пункта меню, можно нажать сочетание Ctrl+Z. Следует помнить, что данная операция производит отмену только
Чем хороша работа с цифровой графикой, так это возможностью отменить неверное действие
.
Программа фотошоп обладает целым арсеналом различных способов, как безболезненно и быстро отменить нежеланное действие. Обо всех этих способах и пойдет речь в данной статье.
https://youtu.be/iQvAto8BqNw
Как отменить выделение в фотошопе
Некоторые инструменты программы требуют выделения определенной области на слое. Не всегда получается с первого раза обвести правильно контур или участок фотографии, поэтому нужно знать, как снимать выделение с картинки. Варианты для решения проблемы:
- Самый простой вариант – через последовательность клавиш Ctrl+D. После их нажатия рамка пропадет. Если зажать их повторно, появится контур всего слоя.
- Многие инструменты снимают выделение при нажатии правой кнопкой мыши на любой области изображения. Единственный нюанс – «Быстрое выделение» среагирует правильно, если нажимать внутри участка.
- Можно воспользоваться контекстным меню, для этого кликните по изображению правой кнопкой и найдите в списке раздел «Отменить выделение». В разных версиях программы и даже инструментах расположение этого пункта может отличаться (где-то на первом месте, а где-то в середине).
- Еще один вариант – перейдите на пункт меню «Выделение», который расположен на панели управления, нажимайте «Отменить выделение».
Восстановить историю (Архивный ластик)
Подобным образом работает функция «Восстановить историю» (Erase to History), действующая через инструмент «Ластик» (Eraser).
Если было удалено что-то лишнее в процессе работы с ластиком, то можно попробовать вернуть промежуточный вариант. Для своего примера я снова по стрелке пущу листики разных цветов. На палитре «История» у меня будет три кисточки.
Так сейчас выглядит мой рисунок.
Допустим, теперь мне надо удалить листочки, идущие по стрелке. Для этого выбираем обычный ластик (клавиша E) подбираем нужный размер кисти (клавиши [ и ]) и проводим им по стрелке.
Теперь мы вернём листочки одного цвета назад на стрелку.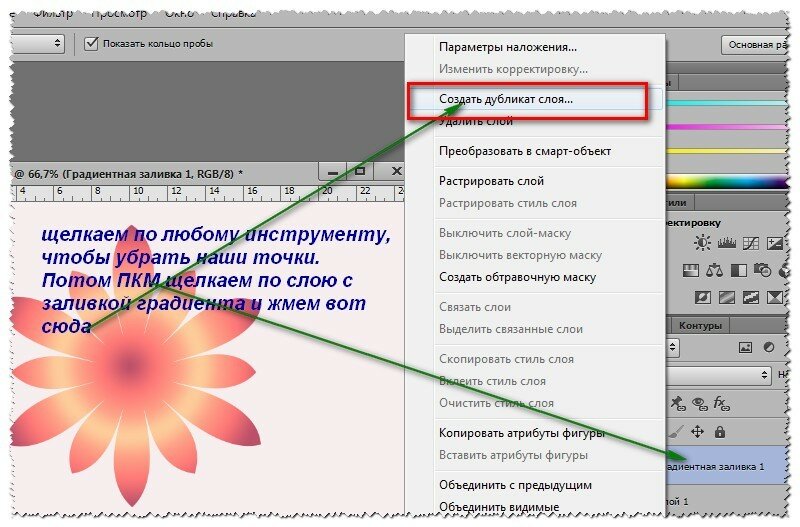 Для этого переходим в палитру «История». Находим необходимую строчку (на которой мы наносили листочки нужного цвета). Нажимаем на неё. Ставим значок архивной кисти (стрелка 1). У нас стало активно окошко «Восстановить историю» (Erase to History). Теперь мы можем поставить галочку (стрелка 2).
Для этого переходим в палитру «История». Находим необходимую строчку (на которой мы наносили листочки нужного цвета). Нажимаем на неё. Ставим значок архивной кисти (стрелка 1). У нас стало активно окошко «Восстановить историю» (Erase to History). Теперь мы можем поставить галочку (стрелка 2).
Переходим в самый конец палитры «История», где мы стёрли листочки, и проводим архивным ластиком по стрелке.
У нас стали появляться листики. Если мы проведем этим ластиком мимо стрелки, то сотрутся листики, нарисованные после нашей выбранной точки отката.
Ещё одно условие работы архивного ластика – в параметрах палитры «История» необходимо поставить птичку напротив «Автоматически создавать первый снимок» (Automatically Create First Snapshot).
Параметры можно найти на палитре «История» сверху справа в строчке с названием палитры четыре горизонтальных черточки.
Данный инструмент может пригодится в том случае, если вы что-то случайно стёрли обычным ластиком, и вам необходимо это вернуть.
Достаточно мудрёный способ, но при необходимости освоить можно.
Как отменить последнее действие в фотошопе
При совершении случайной ошибки или получении результата, которого не ожидали, полезно будет знать, как отменить действие в фотошопе cs5 или cs6. Для этого можно воспользоваться командой горячих клавиш или меню программы. Чтобы вернуть последние изменения:
- В главном меню Photoshop нажмите на раздел «Edit». Выпадет меню, нужно нажать строчку, которая начинается с «Undo», а заканчивается названием примененного инструмента или правки. Это помогает понять, что будет изменено.
- Последовательность клавиш Ctrl+Z вернет вас на шаг назад, удалит последнее применение инструмента.
- В правом столбце найдите раздел под названием «History» (в русской версии «История»). Здесь будут отображены все сделанные вами операции (как правило, последние 20). Кликните на предпоследнюю строчку, это вернет вашу работу в Photoshop к состоянию на шаг назад.
 Иногда это окошко или вкладка отключены, включить отображение можно через настройки меню рабочей области.
Иногда это окошко или вкладка отключены, включить отображение можно через настройки меню рабочей области.
- Лечение грибка на большом пальце ноги: средства от онихомикоза
- Суп из чечевицы: рецепты
- Как приготовить суп харчо
Архивная кисть
В этом способе мы рассмотрим, как вернуть часть изображения назад. В этом нам поможет инструмент «Архивная кисть» (History Brush), который находится на панели инструментов, или клавиша Y (Shift+Y).
Рядом с названием инструмента, если Вы обратили внимание, стоит буква Y. Это значит, что, нажав Y, мы переходим в нужную нам ячейку. А сочетание клавиш Shift+Y перебирает все инструменты, отмеченные Y. Использование горячих клавиш значительно повышает производительность!
Допустим, для примера, я по стрелке пущу облако листочков.
Причем сначала я нарисую желтые и зеленые листики, а следующим действием добавлю красные. При этом на палитре «История» (History) у меня будет две строчки с инструментом «Кисть».
Теперь я хочу убрать красные листики, которые были нарисованы вторыми. Но уберём их не везде, а только по стрелке. Для этого на палитре «История» слева от пиктограммы первой кисточки кликаем в пустое окошечко. Появляется изображение архивной кисти (смотри на стрелку).
Теперь выбираем инструмент «Архивная кисть» (History Brush). Параметры у неё такие же, как и у обычной кисточки. Выставляем нужную непрозрачность и жесткость и убираем всё ненужное с изображения. Для этого проводим Архивной кистью по месту, где нужно убрать изменения. В моём случае – это по стрелке. В итоге красные листочки со стрелки благополучно удалились, а зелёные остались.
Таким способом можно, например, размывать фон на фото. Сначала при помощи фильтра размыть всё фото (не перестарайтесь!), а потом с помощью Архивной кисти вернуть фигуре прежнюю резкость.
Как отменить несколько действий в фотошопе
В некоторых случаях возвращение нужно сделать больше, чем на один шаг. Это может пригодиться, если вносили несколько изменений контрастности, палитры, проводили цветокоррекцию, добавляли яркость, но конечный результат вас не удовлетворил. Загружать заново картинку не хочется, особенно, если были уже внесены необходимые корректировки. Можно использовать варианты, как вернуться на несколько шагов назад:
Это может пригодиться, если вносили несколько изменений контрастности, палитры, проводили цветокоррекцию, добавляли яркость, но конечный результат вас не удовлетворил. Загружать заново картинку не хочется, особенно, если были уже внесены необходимые корректировки. Можно использовать варианты, как вернуться на несколько шагов назад:
- Для последовательной отмены нескольких правок вам необходимо в главном меню найти раздел «Edit» и нажать необходимое количество раз пункт «Step Backward». Нажимайте пункт столько раз, сколько правок нужно стереть.
- Точно такого же эффекта, как описано пунктом выше, можно добиться нажатием горячих клавиш Ctrl+Alt+Z. Пропадать внесенные правки будут в обратном порядке их применения. Будут удалены только те, которые были внесены на изображение, а выбор кистей, цвета останется прежним.
- Чтобы вернуться на несколько шагов назад в один клик, лучше использовать вкладку «История». Найдите это меню справа рабочей области программы (в англоязычной версии подписана «History»). По умолчанию этот список содержит 20 последних изменений, выберите необходимую точку восстановления и кликните на нее. Если перебросило слишком далеко, то нажмите строчку ниже и программа восстановит состояние. Этот вариант помогает удалить или вернуть любые необходимые правки.
Палитра Actions (Операции)
Чтобы открыть палитру Actions (Операции) выполните Window (Окно) > Actions (Операции). Палитру можно использовать для записи, воспроизведения, редактирования и удаления отдельных операций. Эта палитра также позволяет сохранять и загружать файлы операций.
В фототошопе есть набор готовых экшенов от Adobe. На одном из таких наборов действий рассмотрим палитру Actions (Операции).
Она содержит:
1. Список наборов операций. Слева от имени есть изображение папки и треугольник. Если нажать на треугольник — откроется список операций, которые есть в данном наборе.
2. Список записанных операций. Если нажать на треугольник слева — откроется перечень команд, из которых состоит данная операция, указаны команды в порядке их выполнения.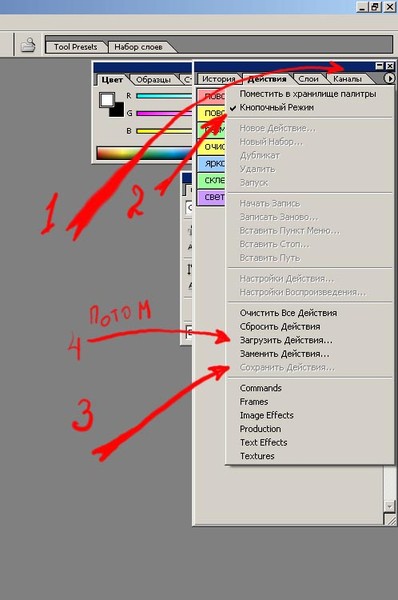 Флажок показывает, включена команда или нет. Квадратик — модальное управление (включено диалоговое окно).
Флажок показывает, включена команда или нет. Квадратик — модальное управление (включено диалоговое окно).
3. Кнопку открытия меню палитры – треугольник в правом верхнем углу.
4. Внизу кнопки действий: — Stop (остановка выполнения и записи операции) — Begin Recording (Начать запись операции) — Play Selection (Запустить набор или операцию) — Create New Set (Cоздать новый набор операций) — Create New Action (Cоздать новую операцию в выбранном наборе) — delete (Удалить операцию)
Как отмотать назад в фотошопе. Как отменить действие в «Фотошопе CS6»: три простых способа
Бесспорно, программа Photoshop является отличным помощником для многих пользователей. Ее не назовешь очень простой в использовании, однако в этом-то и вся прелесть данного приложения. Независимо от того, насколько высокий ваш уровень владения Фотошопом, вы сможете работать в нем при любом раскладе. Конечно, выполнять, скажем, на уровне профессионального фотографа неопытный юзер не сможет, но выполнить элементарные действия с картинками – всегда пожалуйста.
Данный ликбез не нацелен на то, чтобы научить вас премудростям работы в Photoshop. Наоборот, я хочу рассказать о незамысловатых действиях, которые, впрочем, иногда вызывают вопросы даже у заядлых пользователей. Например, не все знают, как отменить действие в фотошопе cs6, а ведь это невероятно полезный навык! Итак, если вам тоже интересно, как ответить на этот вопрос, присоединяйтесь!
С помощью комбинации клавиш
Думаю, я не открою Америку, если скажу вам, что многое в Фотошопе «подвязано» с теми или иными комбинациями клавиш. Отмена какого-либо действия не является исключением. В данном вопросе главное – запомнить необходимые комбинации, чтобы воспользоваться ими в нужный момент, не прибегая к подсказкам. Ниже я приведу целых три варианта развития событий, которые, я уверен, вам пригодятся.
- Комбинация на клавиатуре клавиш Ctrl+Z позволит вам вернуться назад на один шаг.

- Если к вышеуказанной комбинации вы добавите еще и третью – Alt, то сможете вернуться на несколько шагов назад, в частности, до 20.
- Используя одновременно на клавиатуре кнопки Shift+Ctrl+Z, можно вернуться на несколько шагов вперед, однако помните, что и это действие ограничено 20-ю шагами.
Вот так вот, запомнив одну основную комбинацию, и добавляя к ней ту или иную клавишу, можно отменять свои действия в программе Photoshop.
Используйте настройки
Хочу рассказать еще об одном приеме, который, к сожалению, многие не учитывают. 20 действий, которые можно отменить – это условная цифра, выставленная по умолчанию. При необходимости вы можете ее увеличить, скажем, до 100, и тогда уж точно не бояться, что не получится вернуться на определенный этап своей работы.
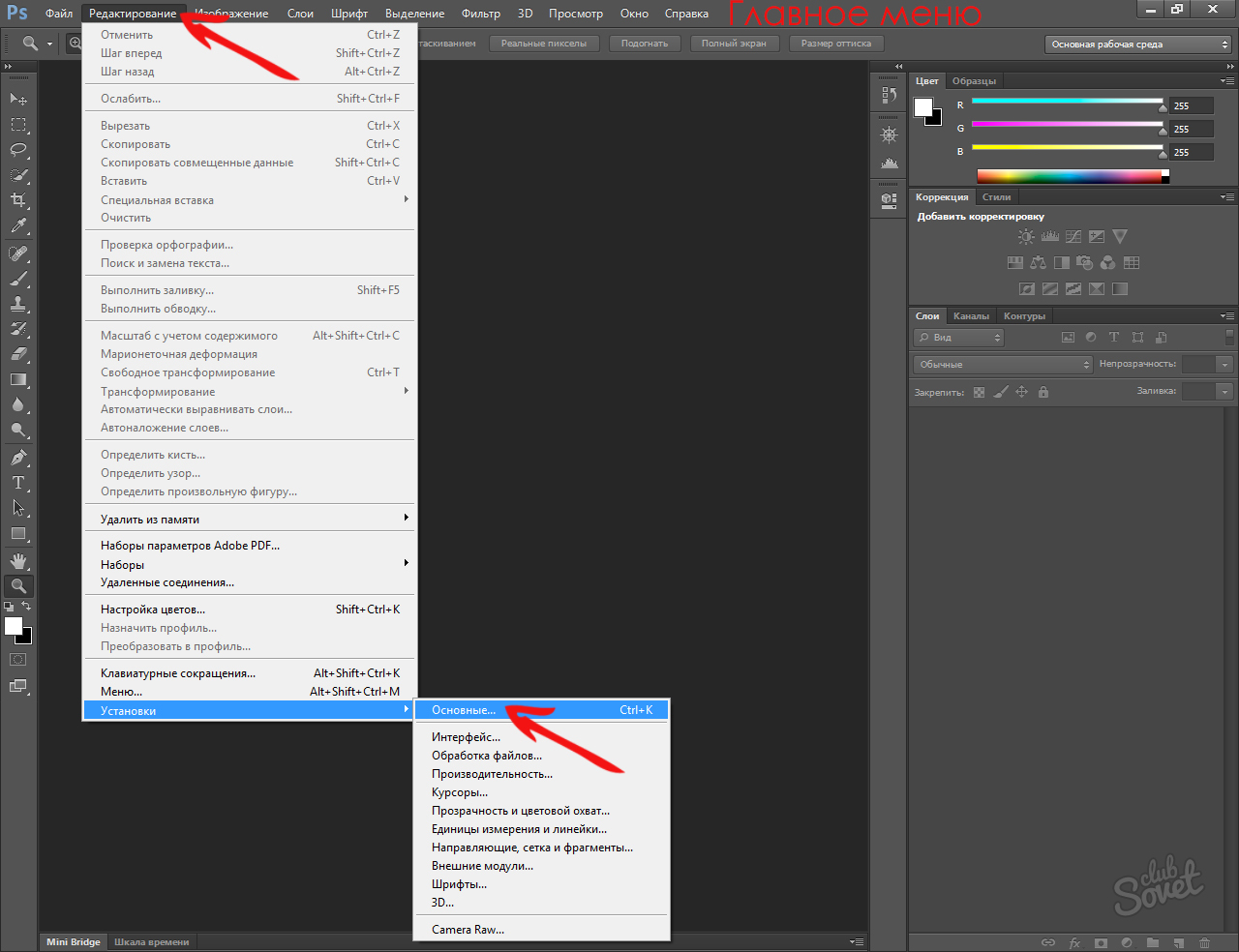
Итак, вот что вам нужно сделать: откройте меню программы, после чего перейдите в раздел редактирования. Там откройте подраздел «Установки» – «Производительность» – «История действий».
А здесь уже задайте любой параметр, например, 100 действий. Хочу обратить ваше внимание на то, что если производительность вашего компьютера оставляет желать лучшего, и он еле вытягивает такую емкую программу, то подобное изменение настроек, скорее всего, повлечет торможение в работе Фотошопа. Также заодно стоит
Как отменить действие, выделение в фотошоп? Таким вопросом задаются все кто только осваивает программу Adobe Photoshop. При работе с графикой часто приходится отменять совершенное действие или выделение. Не понравился совершенный результат или решили сделать по другому. Рисуя карандашом или красками по холсту этого сделать нет возможности. В в мире цифровой графики отменить последние действия обязательная опция любой программы. Кроме того в фотошоп можно отменить не только последнее действие, но и посмотреть всю историю проделанных изменений.
Сочетание клавиш Ctrl+Z отменяют последнее действие, и происходит это только один раз. Это практично, потому что файлы Photoshop имеют большой размер, а поддержка многократной отмены шагов влияет на потребление ресурсов компьютера, что ведет к снижению производительности. Если вы повторно нажмете сочетание клавиш Ctrl+Z , программа Photoshop повторно выполнит отмененное действие. В панели меню эта команда располагается в
Это практично, потому что файлы Photoshop имеют большой размер, а поддержка многократной отмены шагов влияет на потребление ресурсов компьютера, что ведет к снижению производительности. Если вы повторно нажмете сочетание клавиш Ctrl+Z , программа Photoshop повторно выполнит отмененное действие. В панели меню эта команда располагается в
Чтоб отменить изменения на один шаг назад применяйте сочетание клавиш Ctrl+Alt+Z , соответственно если надо отменить несколько последних изменений можно нажать эту комбинацию клавиш несколько раз. В панели меню эта команда располагается в Редактирование — шаг назад .
Более практичнее будет использование панели истории, в которой сохранены все ваши изменения совершенные в процессе работы, где можно выбрать то место куда необходимо вернутся. Она находится, по умолчанию, справа и ее нужно только открыть.
Выглядит она вот так:
Тут записываются все действия, которые вы совершили над изображением. Выделенный пункт соответствует текущему состоянию проекта.
Выделение отменяется сочетанием клавиш Ctrl+D . Вообще все основные сочетания клавиш желательно запомнить, вам будет удобнее и быстрее работать. Конечно же эту функцию можно найти в верхнем меню Выделение — отменить выделение
Как наверное вы смогли заметить если пройдетесь по всем пунктам меню то вы увидите, что самые распространенные сочетания клавиш прописаны напротив функций. В будущем вы запомните самые часто используемые вами действия такие как отменить действие, отменить выделение, копировать вставить и прочее. Набравшись опыта будите пользоваться только сочетаниями клавиш функций которые часто используете исходя из специфики вашей работы или творчества.
Доброго времени суток, дорогие друзья. Представьте себе, что вы сосредоточенно делали какой-то проект в фотошопе. И тут вы уже заканчиваете, доделали все эффекты, все нарисовали и обработали, и даже . И тут вы замечаете, что на итоговом изображении виден нехилый недочет, который резко бросился вам в глаза. Паника, слои слиты. Что делать? Как ретушировать? Несколько часов работы на смарку!
И тут вы замечаете, что на итоговом изображении виден нехилый недочет, который резко бросился вам в глаза. Паника, слои слиты. Что делать? Как ретушировать? Несколько часов работы на смарку!
На самом деле спешу вас успокоить. В этом ничего страшного нет. Можно вернуться на одно ли несколько действий назад, до какого-то определенного момента. И вот сегодня я хотел бы вам рассказать как отменить последнее действие в фотошопе и не волноваться, если вы накосячили.
Итак, поехали!
Отмена с помощью горячих клавиш
Самый простой способ вернуться на определенное количество шагов назад — это воспользоваться комбинациями клавиш.
Для отмены последнего действия нажмите комбинацию клавиш «CTRL+Z» . Но эта связка работает лишь с одним последним действием, т.е. вернуться вы сможете всего лишь на один шаг назад. А уж если нажмете эти клавиши еще раз, то вернетесь к тому, с чего начали.
Для отмены нескольких шагов, вам нужно нажать комбинацию «ALT+CTRL+Z»
Возвращение с помощью палитры «История»
Рассмотрим еще один способ отмены действий, а именно окно «История» . Чем удобен данный способ? Тем, что вы видите какие действия когда вы совершали. Таким образом вы сразу выбираете на какой шаг возвращаться. Ну в общем давайте посмотрим на практике.
Вот так вот легко и удобно можно вернуться на какое-то предыдущее состояние работы. Кроме того «История» позволяет смотреть насколько изменилось изображение по сравнению с оригиналом после редактирования. Для этого просто вернитесь на самый верхний шаг. Посмотрели? Теперь возвращайтесь опять на последний шаг.
Ну как вам возврат? Полезная вещь? Еще бы. Это обязательно нужно знать. И кстати, если вы действительно хотите хорошо знать фотошоп, то обязательно посмотрите видеокурс по работе с ним. Уроки просто потрясающие, никакой воды и всё рассказывается человеческим языком. Очень рекомендую.
Уроки просто потрясающие, никакой воды и всё рассказывается человеческим языком. Очень рекомендую.
Ну а я свой сегодняшний урок заканчиваю и надеюсь, что он вам понравился. А вы в свою очередь не забудьте подписаться на обновления моего блога и рассказать друзьям, тогда всё будет круто. Ну а мы с вами увидимся в других статьях. Пока-пока!
С уважением, Дмитрий Костин.
Ошибочное действие в документе, созданном в MS Word, в меню «Правка» выберите команду «Отменить». Этого же результата можно добиться, используя горячие клавиши Alt+Backspace. Если вы вдруг поняли, что действие было правильным, и зря вы его отменяли, примените сочетание Ctrl+Y.
На панели быстрого доступа найдите кнопку «Отменить». Если требуется отменить сразу несколько действий, нажмите на стрелку вниз рядом с этой кнопкой, чтобы раскрыть список последних совершенных действий. При зажатой левой клавише мыши отметьте курсором ненужные операции и отпустите клавишу. Этого же результата можно добиться, используя сочетание клавиш Ctrl+Alt+Z.
Рядом с «Отменить» на панели быстрого доступа находится кнопка «Вернуть». Она возвращает удаленные шаги. Ее
Для отмены действий в MS Excel также используется команда «Отменить» из меню правка, кнопка «Отменить» на панели быстрого доступа и сочетания клавиш Alt+Backspace и Ctrl+Z. Для возвращения ошибочно отмененных действий применяются те же средства, что и в MS Word.
В Adobe Photoshop в этой ситуации удобно использовать горячие клавиши Ctrl+Alt+Z и команду Step Backward («Шаг назад») из меню Edit («Редактирование»). Для возвращения ошибочно отмененного действия примените команду Step Forward («Шаг вперед») и сочетание Shift+Ctrl+Z.
Кроме стандартных клавиш и команд, в Photoshop есть удобная опция History («История»). Найдите ее в меню Window («Окно») и отметьте галочкой. Найдите на панели History ненужное действие , подцепите его мышкой и перетащите на значок корзины в нижней части панели. Чтобы отменить все изменения, щелкните по иконке изображения в самом верху списка.
Чтобы отменить все изменения, щелкните по иконке изображения в самом верху списка.
Если вы произвели какие-то фатальные изменения в операционной системе, вернуть ее работоспособность вам поможет служба «Восстановление системы». Вызовите окно запуска программ сочетанием Win+R и введите в строку «Открыть» команду msconfig. Перейдите во вкладку «Сервис», отметьте в списке «Восстановление системы» и нажмите «Запустить». Выберите дату, наиболее близкую к той, когда были произведены ошибочные действия.
Источники:
- как вернуть действие назад
При работе в приложениях, редактирующих те или иные файлы, автоматически сохраняется определенное количество предыдущих шагов изменений файла. В некоторых случаях история сохраняется полностью, в других – только ее часть. Практически везде доступна функция восстановления первоначального состояния, однако при условии, что файл не сохранялся в процессе обработки.
Инструкция
Если вам нужно отменить последние , связанные с вводом и форматированием текста в редакторе, окне браузера и проч., для этого просто нажмите сочетание клавиш Ctrl+Z. Также в текстовом редакторе MS Office Word имеется специальная кнопка на панели инструментов, отвечающая за отмену последних изменений. Еще возможен вариант использования меню «Правка», «Отменить». В данном случае если ранее было произведено сохранение процесса редактирования документов, возврат на предыдущую позицию возможен.
Если вам нужно отменить последние изменения, связанные с редактированием изображений в программе Adobe Photoshop, воспользуйтесь сочетанием клавиш Alt+Ctrl+Z или нажмите на пункт меню «Редактирование», затем в выпадающем меню выберите «Шаг назад».
Если хотите полностью восстановить файл, нажмите F12. Если вы уже сохранили изменения, тогда их отмена будет невозможна. При редактировании графических файлов вообще лучше всего создавать и редактировать их копии, а оригиналы хранить отдельно. Также просмотрите историю изменений в специальной таблице изменений, которая доступно из пункта меню «Окно».
Если вы хотите отменить последние изменения, которые повлияли на работу компьютера (например, установка обновлений, программ, утилит), откройте меню «Пуск», выберите меню стандартных программ, затем «Служебные» и, наконец, «Восстановление системы». Перед вами на экране появится большое окно восстановления операционной системы, выберите на календаре программы контрольную точку сохранения параметров до произведения изменений в системе, выполните откат до этой даты.
Имейте в виду, что перед этим лучше всего сохранить личные данные, используемые вами при работе в приложениях, установленных за этот период, поскольку программы будут удалены вместе с ними. Это могут быть различные логины и пароли учетных записей, файлы ключей, ссылки и так далее.
Источники:
- как быть если тебе измении
При работе с изображениями в «Фотошопе » может потребоваться отменить предыдущее действие и вернуться к исходной картинке. Для возвращения к предыдущему результату нужно выполнить несколько действий..
Вам понадобится
- — компьютер;
- — любая версия программы «Фотошоп».
Инструкция
Работа с изображениями – увлекательное занятие, которое требует от фотомастера определенных знаний и умений. Но даже у опытного пользователя «Фотошопа» нередко возникают ситуации, когда в ходе работы над созданием нового шедевра нужно вернуться на несколько шагов назад.
Внести изменения в обрабатываемое фото можно на любом этапе редактирования. Правда, пред началом работы вам, естественно, нужно открыть изображение. Для этого достаточно одновременно нажать клавиши клавиатуры Alt+Shift+Ctr+O или в меню «Файл», что на рабочей панели, выбрать опцию «Открыть как», после чего указать место расположения изображения и его формат.
Далее приступайте к непосредственной обработке. А если потребуется внести изменения и вернуться назад, загляните в раздел «Редактирование» на рабочей панели. Здесь вы сможете произвести необходимые операции, выбрав соответствующую опцию: «Отменить», «Шаг назад» и «Шаг назад».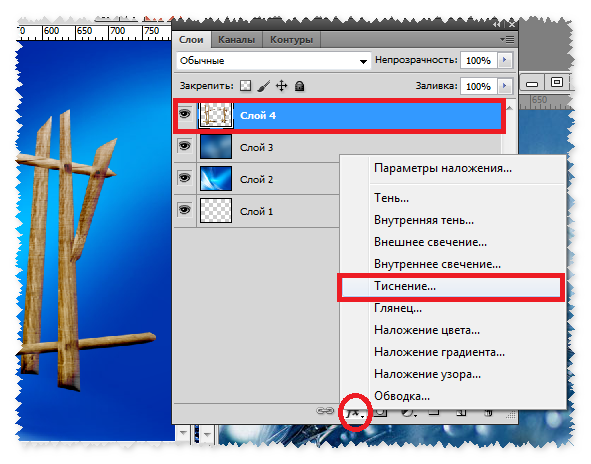
Для удобства вы можете воспользоваться «горячими клавишами»: Ctrl+Z – для отмены последнего действия, Shift+Ctrl+Z — для совершения шага вперед и Alt+Ctrl+Z – для выполнения шага назад.
Просмотреть всю историю изменений изображения в «Фотошопе » также можно, выбрав соответствующую операцию в меню «Окно» верхней панели. Отметьте галочкой пункт «История» в данном разделе, и в рабочем окне появится таблица, демонстрирующая все выполненные с картинкой действия.
Для отмены совершенных изменений на каком-либо этапе обработки изображения достаточно на экране «История» найти нужную операцию и вернуться к ней, кликнув по ней левой кнопкой мыши. В данном случае вы окажетесь именно на том шаге редактирования, на который укажете.
Если же вам нужно сохранить на фотографии все ранее произведенные действия, оставьте для себя черновой вариант изображения. Ведь он вам может еще понадобиться. А чтобы не запутаться , при сохранении придумайте ей название, по которому вы легко сориентируетесь во всех своих фотографиях, законченных и находящихся пока на стадии обработки.
Процедура отмены и удаления установленных обновлений операционной системы Microsoft Windows представляет из себя стандартную операцию, не требующую привлечения дополнительного программного обеспечения.
Инструкция
Вызовите главное системное меню, нажав кнопку «Пуск», и перейдите в пункт «Панель управления». Раскройте ссылку «Программы» и разверните узел «Просмотр установленных обновлений» в разделе «Программы и компоненты». Найдите подлежащее удалению обновление в списке открывшегося диалогового окна и вызовите его контекстное меню кликом правой кнопки мыши. Укажите команду «Удалить» и нажмите кнопку «Да» в открывшемся окошке запроса системы. Дождитесь завершения процесса.
Если речь идет об обновлении SP3 для Windows XP, воспользуйтесь возможностью удаления в скрытой системной папке $NTServicePackUninstall$. Для этого вернитесь в главное меню «Пуск» и перейдите в диалог «Выполнить». Напечатайте
Напечатайте
имя_диска:\windows\$NTServicePackUninstall$\spuninst.exe
в строке «Открыть» и запуск утилиты мастера удаления пакета обновления, нажав кнопку OK. Подтвердите выполнение выбранного действия, нажав кнопку «Далее» в главном окне мастера и выполните все его рекомендации.
Одним из наиболее распространенных способов отмены установленного обновления можно считать использование функции восстановления прежнего состояния системы. Для применения данного способа удостоверьтесь в том, что компьютер был перезагружен хотя бы один раз после установки обновления и вызовите главное системное меню, нажав кнопку «Пуск». Перейдите в диалог «Выполнить» и напечатайте
%systemroot%\System32\restore\rstrui.exe
в строке «Открыть». Подтвердите запуск утилиты, нажав кнопку OK, и укажите опцию «Восстановление более раннего состояния компьютера» в открывшемся диалоговом окне. Подтвердите выполнение выбранного действия, нажав кнопку «Далее», и выберите желаемую дату для отката системы. Сохраните сделанные изменения, нажав кнопку «Далее» и выполните все рекомендации мастера восстановления. Перезагрузите компьютер для применения сделанных изменений.
Источники:
- Удаление пакета обновления SP3 для Windows XP
- как отменить установленные обновления
Редактор Adobe Photoshop является мощным инструментом обработки цифровых изображений. Это средство для решения профессиональных задач. Вследствие ориентированности на профессиональную среду, Photoshop не славится простотой. Поэтому у новичков, использующих Photoshop, возникает масса вопросов. Один из первых, пожалуй, будет о том, как отменить в фотошопе сделанные изменения.
Вам понадобится
- Графический редактор Adobe Photoshop.
Инструкция
Отмените последнее совершенное действие . Для этого выберите в главном меню приложения пункт «Edit». В раскрывшемся выпадающем меню кликните на пункт, название которого начинается со «Undo». Название данного пункта из слова «Undo» со следующим за ним названием последнего примененного инструмента или совершенного действия. Поэтому всегда можно видеть, какая операция будет отменена. Вместо выбора указанного пункта меню, можно нажать сочетание Ctrl+Z. Следует помнить, что данная операция производит отмену только
Название данного пункта из слова «Undo» со следующим за ним названием последнего примененного инструмента или совершенного действия. Поэтому всегда можно видеть, какая операция будет отменена. Вместо выбора указанного пункта меню, можно нажать сочетание Ctrl+Z. Следует помнить, что данная операция производит отмену только
Как в Фотошопе отменить действие?
Есть на клавиатуре такие интересные клавиши, которые отменяют последнее действие в фотошопе.
Это две клавиши, их нужно нажать одновременно CTRL+Z. Они находятся рядом в левой части клавиатуры. Думаю одновременно не составит нажать две эти клавиши.
Быстро, легко, удобно и доступно)
Обычно, чтобы отменить действие в фотошоп я использую историю, но в истории у меня можно отменять 20 шагов. Я думаю, что и в Вашем фотошоп тоже самое. Чтобы не терять информацию я обычно при редактировании использую смарт объекты, например, когда в работе требуется к изображению применить несколько фильтров,таким образом в палитре слов всегда можно вернуться к этим фильтрам и изменить настройки фильтров.
Отменить действие в Adobe Photoshop можно при помощи сочетания quot;горячих клавишquot; Ctrl+Z . Так же в этой программе есть окно в котором отображаются последние операции, в нем также можно отменить крайние действия в случаи необходимости.
Можно отменить действие через верхнее меню Редактирование или воспользоваться горячими клавишами Ctrl+Z. Если необходимо отменить несколько действий, то можно использовать сочетание клавиш Ctrl+Alt+Z (отменяет действие по шагам). очень удобно использовать дополнительное окно История (чтобы включить его, нужно зайти в верхнее меню Окно и выбрать из списка История). В настройках самого фотошопа можно поставить количество действий, которое храниться в Окне История, но учтите что это будет нагружать оперативную память.
Справа есть небольшое окно, где показаны все действия, если выделить действие выполненное ранее, например, на 5 шагов и удалить в корзину, то все последующие действия удалятся
Отменить действие в Фотошопе можно с помощью горячих клавиш CTRL+Z — после применения сочетания этих клавиш вы вернтесь на один шаг назад. Но так же вы можете вернуться на один шаг назад или на большее количество шагов назад, если будете использовать окно История , которое можно активировать с помощью меню Окно . Обычно в этом окне уже запрограммировано на запоминание 16-20 шагов. Количество шагов устанавливается с помощью команды Редактирование-Установки .
Но так же вы можете вернуться на один шаг назад или на большее количество шагов назад, если будете использовать окно История , которое можно активировать с помощью меню Окно . Обычно в этом окне уже запрограммировано на запоминание 16-20 шагов. Количество шагов устанавливается с помощью команды Редактирование-Установки .
1.В том случае, если потребуется вернуться назад, тогда открываем quot;Редактирование quot; и здесь выбираем такую опцию, как quot;Отменитьquot; или quot;Шаг назадquot;.
2.Помощь quot;горячих клавишquot; :
Ctrl+Z для отмены последнего действия;
Alt+Ctrl+Z для выполнения шага назад.
3.Для отмены совершенных изменений открываем quot;История quot;, находим нужную операцию и возвращаемся к ней, кликнув по ней левой кнопкой мыши. Вы вернтесь на тот шаг на который кликнете.
Читайте также…
Как отменить действие в адоб фотошоп. Как сделать отмену последнего действия в фотошопе если вы накосячили
Как в Фотошопе отменить действие?
Есть на клавиатуре такие интересные клавиши, которые отменяют последнее действие в фотошопе.
Это две клавиши, их нужно нажать одновременно CTRL+Z. Они находятся рядом в левой части клавиатуры. Думаю одновременно не составит нажать две эти клавиши.
Быстро, легко, удобно и доступно)
Обычно, чтобы отменить действие в фотошоп я использую историю, но в истории у меня можно отменять 20 шагов. Я думаю, что и в Вашем фотошоп тоже самое. Чтобы не терять информацию я обычно при редактировании использую смарт объекты, например, когда в работе требуется к изображению применить несколько фильтров,таким образом в палитре слов всегда можно вернуться к этим фильтрам и изменить настройки фильтров.
Отменить действие в Adobe Photoshop можно при помощи сочетания quot;горячих клавишquot; Ctrl+Z . Так же в этой программе есть окно в котором отображаются последние операции, в нем также можно отменить крайние действия в случаи необходимости.
Так же в этой программе есть окно в котором отображаются последние операции, в нем также можно отменить крайние действия в случаи необходимости.
Можно отменить действие через верхнее меню Редактирование или воспользоваться горячими клавишами Ctrl+Z. Если необходимо отменить несколько действий, то можно использовать сочетание клавиш Ctrl+Alt+Z (отменяет действие по шагам). очень удобно использовать дополнительное окно История (чтобы включить его, нужно зайти в верхнее меню Окно и выбрать из списка История). В настройках самого фотошопа можно поставить количество действий, которое храниться в Окне История, но учтите что это будет нагружать оперативную память.
Справа есть небольшое окно, где показаны все действия, если выделить действие выполненное ранее, например, на 5 шагов и удалить в корзину, то все последующие действия удалятся
Отменить действие в Фотошопе можно с помощью горячих клавиш CTRL+Z — после применения сочетания этих клавиш вы вернтесь на один шаг назад. Но так же вы можете вернуться на один шаг назад или на большее количество шагов назад, если будете использовать окно История , которое можно активировать с помощью меню Окно . Обычно в этом окне уже запрограммировано на запоминание 16-20 шагов. Количество шагов устанавливается с помощью команды Редактирование-Установки .
1.В том случае, если потребуется вернуться назад, тогда открываем quot;Редактирование quot; и здесь выбираем такую опцию, как quot;Отменитьquot; или quot;Шаг назадquot;.
2.Помощь quot;горячих клавишquot; :
Ctrl+Z для отмены последнего действия;
Alt+Ctrl+Z для выполнения шага назад.
3.Для отмены совершенных изменений открываем quot;История quot;, находим нужную операцию и возвращаемся к ней, кликнув по ней левой кнопкой мыши. Вы вернтесь на тот шаг на который кликнете.
При работе с Photoshop очень часто возникает потребность в отмене ошибочных действий. В этом и заключается одно из преимуществ графических программ и цифровой фотографии: можно не бояться ошибиться или пойти на смелый эксперимент. Ведь всегда есть возможность убрать последствия без ущерба для оригинала или основной работы.
Ведь всегда есть возможность убрать последствия без ущерба для оригинала или основной работы.
В этой публикации пойдет речь о том, как можно отменить последнюю операцию в Photoshop. Сделать это можно тремя способами:
1. Комбинация клавиш
2. Команда меню
3. Использование истории
Рассмотрим их более детально.
С этим способом отмены последних действий знаком каждый опытный пользователь, особенно, если он пользуется редакторами текстов. Это системная функция и по умолчанию присутствует в большинстве программ. При нажатии на эту комбинацию происходит последовательная отмена последних действий до достижения необходимого результата.
В случае с Photoshop у этой комбинации есть свои особенности – она работает только однократно. Приведем небольшой пример. С помощью инструмента Кисть нарисуем две точки. Нажатие Ctrl+Z приводит к удалению последней точки. Повторное нажатие не приведет к удалению первой поставленной точки, а только «удалит удаленное», то есть вернет на место вторую точку.
Способ №2. Команда меню «Шаг назад»
Вторым способом отмены последнего действия в Photoshop является использование команды меню «Шаг назад» . Это более удобный вариант поскольку позволяет отменить необходимое количество неверных действий.
По умолчанию в программе запрограммирована отмена 20 последних пользовательских действий. Но это число можно легко увеличить с помощью тонкого тюнинга.
Для этого необходимо последовательно перейти по пунктам .
Затем в подпункте «История действий» устанавливается требуемое значение параметра. Интервал, доступный для пользователя составляет 1-1000 .
Такой способ отмены последних пользовательских действий в Photoshop удобен для любителей поэкспериментировать с различными возможностями, которые предоставляет программа. Также полезна эта команда меню новичкам при освоении Фотошопа.
Также удобно пользоваться сочетанием CTRL+ALT+Z , которое закреплено за этой командой разработчиками.
Стоит отметить, что в Photoshop предусмотрена и функция возврата отмены последнего действия. Она вызывается с помощью команды меню «Шаг вперед» .
Способ №3. Использование палитры истории
На главном окне Photoshop есть дополнительное окно «История» . В нем фиксируются все пользовательские действия, предпринятые при работе с изображением или фотографией. Каждое из них выводится в виде отдельной строки. Она содержит миниатюру и название использованной функции или инструмента.
Если у вас на главном экране такого окна нет, то вызвать его отображение можно, выбрав «Окно — История» .
По умолчанию Photoshop отображает в окне палитра история 20 операций пользователя. Этот параметр, как уже было сказано выше, легко меняется в диапазоне 1-1000 с помощью меню «Редактирование — Установки — Производительность» .
Использование «Истории» очень простое. Достаточно нажать на необходимую строчку в этом окне и программа выполнит возврат к этому состоянию. При этом все последующие действия станут подсвечиваться серым цветом.
Если изменить выбранное состояние, например, использовать другой инструмент, то все последующие действия, подсвеченные серым, удалятся.
Таким образом можно отменить или выбрать любое предыдущее действие в Фотошопе.
Доброго времени суток, дорогие друзья. Представьте себе, что вы сосредоточенно делали какой-то проект в фотошопе. И тут вы уже заканчиваете, доделали все эффекты, все нарисовали и обработали, и даже . И тут вы замечаете, что на итоговом изображении виден нехилый недочет, который резко бросился вам в глаза. Паника, слои слиты. Что делать? Как ретушировать? Несколько часов работы на смарку!
На самом деле спешу вас успокоить. В этом ничего страшного нет. Можно вернуться на одно ли несколько действий назад, до какого-то определенного момента. И вот сегодня я хотел бы вам рассказать как отменить последнее действие в фотошопе и не волноваться, если вы накосячили.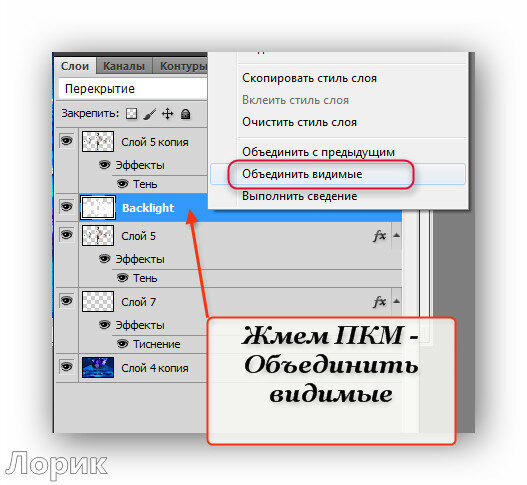
Итак, поехали!
Отмена с помощью горячих клавиш
Самый простой способ вернуться на определенное количество шагов назад — это воспользоваться комбинациями клавиш.
Для отмены последнего действия нажмите комбинацию клавиш «CTRL+Z» . Но эта связка работает лишь с одним последним действием, т.е. вернуться вы сможете всего лишь на один шаг назад. А уж если нажмете эти клавиши еще раз, то вернетесь к тому, с чего начали.
Для отмены нескольких шагов, вам нужно нажать комбинацию «ALT+CTRL+Z» . Тогда каждое нажатие данной комбинации будет отменять предыдущее действие, пока вы не вернетесь к нужному шагу, когда еще все было хорошо. Очень быстро и удобно.
Возвращение с помощью палитры «История»
Рассмотрим еще один способ отмены действий, а именно окно «История» . Чем удобен данный способ? Тем, что вы видите какие действия когда вы совершали. Таким образом вы сразу выбираете на какой шаг возвращаться. Ну в общем давайте посмотрим на практике.
Вот так вот легко и удобно можно вернуться на какое-то предыдущее состояние работы. Кроме того «История» позволяет смотреть насколько изменилось изображение по сравнению с оригиналом после редактирования. Для этого просто вернитесь на самый верхний шаг. Посмотрели? Теперь возвращайтесь опять на последний шаг.
Ну как вам возврат? Полезная вещь? Еще бы. Это обязательно нужно знать. И кстати, если вы действительно хотите хорошо знать фотошоп, то обязательно посмотрите видеокурс по работе с ним. Уроки просто потрясающие, никакой воды и всё рассказывается человеческим языком. Очень рекомендую.
Ну а я свой сегодняшний урок заканчиваю и надеюсь, что он вам понравился. А вы в свою очередь не забудьте подписаться на обновления моего блога и рассказать друзьям, тогда всё будет круто. Ну а мы с вами увидимся в других статьях. Пока-пока!
С уважением, Дмитрий Костин.
Зачастую при работе с любой программой и даже на любом сервере можно сделать отмену действий.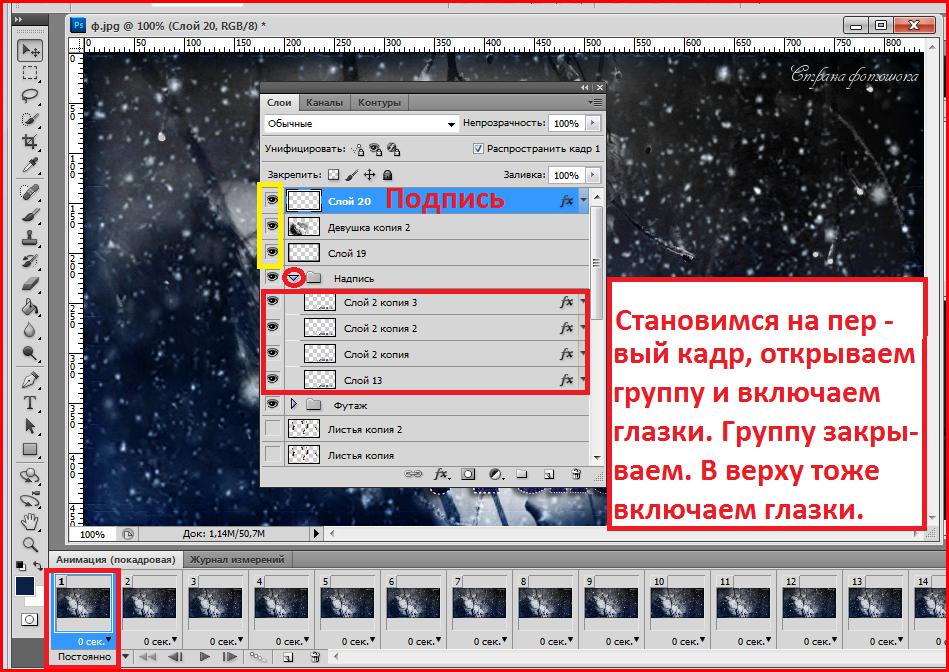 Дело в том, что неизбежны ошибки или опечатки, а также случайное нажатие клавиш, поэтому имеется и возможность вернуть все, как было.
Дело в том, что неизбежны ошибки или опечатки, а также случайное нажатие клавиш, поэтому имеется и возможность вернуть все, как было.
В этой статье мы поговорим о том, как отменить действие в «Фотошопе CS6». Нередко новички, сделав что-то неправильно, полагают, что ничего исправить нельзя. Но это не так. Давайте посмотрим, какие действия можно предпринять, если при работе с программой нужно совершить «откат». Для наглядности в статье представлены иллюстрации.
Основные сведения о работе в программе «Фотошоп»
«Фотошоп» — очень сложная графическая программа, имеющая множество функций для создания различных спецэффектов. Любую фотографию можно изменить до неузнаваемости, либо создать сказочный коллаж. Но чтобы получилось все красиво и выглядело безупречно, нужно придерживаться определенной последовательности действий.
Даже профессионал может совершить ошибку, кроме того, он постоянно изучает, экспериментирует, сравнивает. Поэтому в подобной программе без функции отмены не обойтись. Только в отличие от тех же офисных программ, загнутая стрелочка, означающая отмену, здесь спрятана в меню. Кроме того, существует функция отката сразу нескольких последних действий.
Об этом подробнее будет чуть ниже. А сейчас кратко рассмотрим все варианты, как отменить действие в «Фотошопе CS6»:
- через горизонтальное меню;
- при помощи горячих клавиш;
- через окно «История».
Пожалуй, этих трех вариантов вполне достаточно, но самыми удобными и востребованными являются последние два.
Какие причины бывают для отмены действий?
Существует множество причин, по которым можно отменить действие. Например, вы сделали надпись на фото при помощи инструмента «Кисть», но получилось некрасиво. И вы задумались о том, как отменить действие в «Фотошопе CS6». Можно, конечно, воспользоваться инструментом «Ластик», но при этом сотрется содержимое всего активного слоя.
То есть у вас активен слой «Фотография_1» с изображением цветка. А на его фоне вы сделали надпись «С 8 марта!». Таким образом, применив виртуальный ластик, вы рискуете стереть не только текст, но и фон. Чтобы этого не произошло, лучше отменить действия.
А на его фоне вы сделали надпись «С 8 марта!». Таким образом, применив виртуальный ластик, вы рискуете стереть не только текст, но и фон. Чтобы этого не произошло, лучше отменить действия.
Другая ситуация: работая со слоями, мастер понял, что фотография получается не очень удачной. Нужно отменить сразу несколько действия, чтобы вернуться не к исходному рисунку, а к тому моменту, когда все красиво получалось. Можно легко и быстро сделать даже эту процедуру.
Выше мы перечислили кратко, как отменить последнее действие в «Фотошопе CS6», а также сразу несколько. Стоит теперь приступить к подробному изучению процесса отмены.
Отмена через меню «Редактирование»
Откройте программу «Фотошоп». Загрузите нужную картинку и примените к ней несколько действий, например: обесцветьте и нанесите надпись разными цветами при помощи кисти. Чтобы отменить действие с последней кистью, направьте курсор на верхнюю часть экрана, где располагается горизонтальное меню. Выберете второй пункт «Редактирование» (Edit). Обратите внимание на самые верхние три команды:
- «Отменить».
- «Шаг вперед».
- «Шаг назад».
Эти команды придуманы неслучайно. Вернемся к примеру с написанным кисточкой текстом. Вы сделали ошибку, или вам не понравилось, когда нарисовали первую букву. Нужно вернуться назад. У вас есть два способа: нажать или «Отменить», или «Шаг назад». Но если бы вы нарисовали уже две буквы, а надо стереть обе, то нужно «Отменить» нажать дважды. Если же вы посчитаете, что команда применена напрасно, то нажмите «Шаг вперед» и текст вернется.
Чтобы лучше понять, как отменить действие в «Фотошопе CS6» при помощи команд меню, рекомендуем попрактиковаться. Кроме того, при желании, вы можете заучить горячие клавиши, которые указаны справа от названия команд в меню. То есть, если вы нажмете на клавиатуре Ctrl+Z , то вы сразу вернете изображение в предыдущее состояние.
Отмена через окно «История»
А теперь изучим более сложный процесс — как отменить несколько действий в «Фотошопе CS6». Для этого вам нужно сделать открытым окно «История» (оно обычно идет отдельной вкладкой с окнами «Слои» и «Свойства»). Если его нет, то в меню «Окно» (Window) найдите пункт «История» (History).
Для этого вам нужно сделать открытым окно «История» (оно обычно идет отдельной вкладкой с окнами «Слои» и «Свойства»). Если его нет, то в меню «Окно» (Window) найдите пункт «История» (History).
Именно в нем указана последовательность действий и названия операций. Нужно выделить нижние операции, которые являются лишними, либо поставить галочки на ненужные команды выборочно и нажать «Корзину» внизу окна, согласившись с действием по удалению.
Надеемся, что вы смогли понять, как нужно отменять действие в «Фотошопе CS6». Нет ничего сложного, а главное — можно выбрать наиболее удобный способ.
Зачастую при работе с любой программой и даже на любом сервере можно сделать отмену действий. Дело в том, что неизбежны ошибки или опечатки, а также случайное нажатие клавиш, поэтому имеется и возможность вернуть все, как было.
В этой статье мы поговорим о том, как отменить действие в «Фотошопе CS6». Нередко новички, сделав что-то неправильно, полагают, что ничего исправить нельзя. Но это не так. Давайте посмотрим, какие действия можно предпринять, если при работе с программой нужно совершить «откат». Для наглядности в статье представлены иллюстрации.
Основные сведения о работе в программе «Фотошоп»
«Фотошоп» — очень сложная графическая программа, имеющая множество функций для создания различных спецэффектов. Любую фотографию можно изменить до неузнаваемости, либо создать сказочный коллаж. Но чтобы получилось все красиво и выглядело безупречно, нужно придерживаться определенной последовательности действий.
Даже профессионал может совершить ошибку, кроме того, он постоянно изучает, экспериментирует, сравнивает. Поэтому в подобной программе без функции отмены не обойтись. Только в отличие от тех же офисных программ, загнутая стрелочка, означающая отмену, здесь спрятана в меню. Кроме того, существует функция отката сразу нескольких последних действий.
Об этом подробнее будет чуть ниже. А сейчас кратко рассмотрим все варианты, как отменить действие в «Фотошопе CS6»:
- через горизонтальное меню;
- при помощи горячих клавиш;
- через окно «История».

Пожалуй, этих трех вариантов вполне достаточно, но самыми удобными и востребованными являются последние два.
Какие причины бывают для отмены действий?
Существует множество причин, по которым можно отменить действие. Например, вы сделали надпись на фото при помощи инструмента «Кисть», но получилось некрасиво. И вы задумались о том, как отменить действие в «Фотошопе CS6». Можно, конечно, воспользоваться инструментом «Ластик», но при этом сотрется содержимое всего активного слоя.
То есть у вас активен слой «Фотография_1» с изображением цветка. А на его фоне вы сделали надпись «С 8 марта!». Таким образом, применив виртуальный ластик, вы рискуете стереть не только текст, но и фон. Чтобы этого не произошло, лучше отменить действия.
Другая ситуация: работая со слоями, мастер понял, что фотография получается не очень удачной. Нужно отменить сразу несколько действия, чтобы вернуться не к исходному рисунку, а к тому моменту, когда все красиво получалось. Можно легко и быстро сделать даже эту процедуру.
Выше мы перечислили кратко, как отменить последнее действие в «Фотошопе CS6», а также сразу несколько. Стоит теперь приступить к подробному изучению процесса отмены.
Отмена через меню «Редактирование»
Откройте программу «Фотошоп». Загрузите нужную картинку и примените к ней несколько действий, например: обесцветьте и нанесите надпись разными цветами при помощи кисти. Чтобы отменить действие с последней кистью, направьте курсор на верхнюю часть экрана, где располагается горизонтальное меню. Выберете второй пункт «Редактирование» (Edit). Обратите внимание на самые верхние три команды:
- «Отменить».
- «Шаг вперед».
- «Шаг назад».
Эти команды придуманы неслучайно. Вернемся к примеру с написанным кисточкой текстом. Вы сделали ошибку, или вам не понравилось, когда нарисовали первую букву. Нужно вернуться назад. У вас есть два способа: нажать или «Отменить», или «Шаг назад». Но если бы вы нарисовали уже две буквы, а надо стереть обе, то нужно «Отменить» нажать дважды.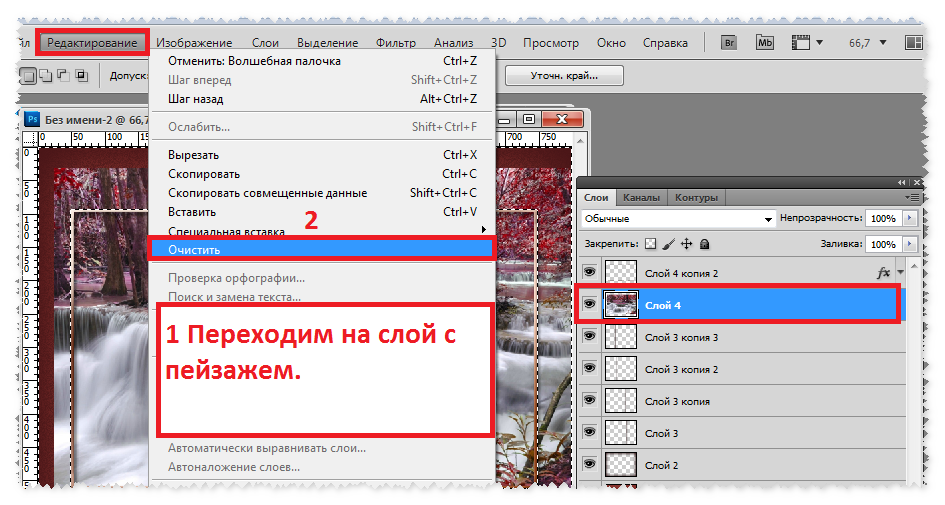 Если же вы посчитаете, что команда применена напрасно, то нажмите «Шаг вперед» и текст вернется.
Если же вы посчитаете, что команда применена напрасно, то нажмите «Шаг вперед» и текст вернется.
Чтобы лучше понять, как отменить действие в «Фотошопе CS6» при помощи команд меню, рекомендуем попрактиковаться. Кроме того, при желании, вы можете заучить горячие клавиши, которые указаны справа от названия команд в меню. То есть, если вы нажмете на клавиатуре Ctrl+Z , то вы сразу вернете изображение в предыдущее состояние.
Отмена через окно «История»
А теперь изучим более сложный процесс — как отменить несколько действий в «Фотошопе CS6». Для этого вам нужно сделать открытым окно «История» (оно обычно идет отдельной вкладкой с окнами «Слои» и «Свойства»). Если его нет, то в меню «Окно» (Window) найдите пункт «История» (History).
Именно в нем указана последовательность действий и названия операций. Нужно выделить нижние операции, которые являются лишними, либо поставить галочки на ненужные команды выборочно и нажать «Корзину» внизу окна, согласившись с действием по удалению.
Надеемся, что вы смогли понять, как нужно отменять действие в «Фотошопе CS6». Нет ничего сложного, а главное — можно выбрать наиболее удобный способ.
Вернуть отмененное действие клавиши. Как на компьютере вернуть последнее действие
При использовании компьютера у юзеров часто возникает ситуация, когда какое-то действие было выполнено случайно или неправильно, например, удаление или переименование файлов. Специально для таких случаев разработчики операционной системы Windows придумали удобную функцию, отменяющую последнее действие. Кроме этого осуществляется данный процесс и с помощью других инструментов. В этой статье мы подробно опишем методы отмены последних действий на компьютере.
Обычно случайно выполненные операции на ПК можно вернуть с помощью специальной горячей клавиши, однако не всегда такая манипуляция сработает. Поэтому придется прибегнуть к осуществлению определенных инструкций через встроенные утилиты или специальное программное обеспечение. Давайте детально рассмотрим все эти методы.
Давайте детально рассмотрим все эти методы.
Способ 1: Встроенная функция Windows
Как уже было сказано выше, в ОС Windows присутствует встроенная функция, отменяющая последнее действие. Активируется она с помощью горячей клавиши Ctrl + Z или через всплывающее меню. Если вы, например, случайно не так переименовали файл, просто зажмите указанную выше комбинацию или нажмите на свободной области правой кнопкой мыши и выберите пункт «Отменить переименование» .
При перемещении файла в корзину данное сочетание клавиш также работает. Во всплывающем меню нужно кликнуть на пункт «Отменить удаление» . Если же данные были удалены безвозвратно, следует воспользоваться специальным программным обеспечением или встроенной утилитой. Ниже мы подробно разберем этот метод восстановления.
Способ 2: Отмена действий в программах
Многие пользователи активно задействуют в работе за компьютером различный софт, например, для редактирования текста и изображений. В таких программах чаще всего работает стандартное сочетание клавиш Ctrl + Z , однако в них еще имеются встроенные инструменты, позволяющие откатить действие. Самым популярным текстовым редактором является . В нем на панели вверху присутствует специальная кнопка, отменяющая ввод. Подробнее об отмене действий в Ворде читайте в нашей статье по ссылке ниже.
Стоит обратить внимание и на графические редакторы. Возьмем за пример . В нем во вкладке «Редактирование» вы найдете ряд инструментов и горячих клавиш, позволяющих выполнить шаг назад, отменить редактирование и многое другое. У нас на сайте присутствует статья, в которой подробно описан данный процесс. Читайте ее по ссылке ниже.
Практически во всем подобном софте присутствуют инструменты, выполняющие отмену действий. Нужно только внимательно изучить интерфейс и ознакомиться с горячими клавишами.
Способ 3: Восстановление системы
В случае безвозвратного удаления файлов восстановление их выполняется с помощью встроенного средства Windows или с использованием специального ПО. Системные файлы возвращаются отдельными методами, через командную строку или вручную. Подробные инструкции вы найдете в нашей статье по ссылке ниже.
Системные файлы возвращаются отдельными методами, через командную строку или вручную. Подробные инструкции вы найдете в нашей статье по ссылке ниже.
Обычные же данные восстанавливать проще всего через стороннее программное обеспечение. Они позволяют сканировать определенные разделы жесткого диска и возвращать только нужную информацию. Знакомьтесь со списком лучших представителей подобного софта в статье ниже.
Иногда некоторые манипуляции приводят к сбоям в работе системы, поэтому приходится задействовать встроенное или стороннее средство. Такие инструменты заранее создают резервную копию Windows, а в случае надобности восстанавливают ее.
В этой статье описываются три операции, которые помогут вам отменить ошибочные действия и повысить эффективность редактирования.
Отмена действий
Вы можете отменить почти все команды, выполненные в Excel, с помощью команды Отменить , расположенной на панели быстрого доступа. Панель быстрого доступа, как правило, отображается слева от строки заголовка Excel. Вы также можете нажимать Ctrl+Z для отмены действий.
Выберите Отменить , после того как по ошибке выполнили какую-нибудь команду, и эта команда будет отменена, как будто вы ее вообще никогда и не выполняли. Вы можете отменить результат последних 100 выполненных команд, нажимая кнопку Отменить много раз.
Однако некоторые действия вы не сможете отменить. Все команды, выполняемые с помощью кнопки Файл , например сохранение книги, нельзя отменить. Если вы нажмете кнопку по стрелкой, расположенную справа от кнопки Отменить , то увидите список последних команд, которые можно отменить (рис. 6.1). Можно выделить сразу набор таких команд, чтобы отменить несколько действий одним щелчком. Па рисунке выделены семь действий.
Имейте в виду, что вы не можете отменить эффект выполнения макроса. На самом деле запуск макроса, изменяющего лист, стирает всю информацию относительно отмены действий. Этого ощутимого недостатка Excel нет в Microsoft Word.
Этого ощутимого недостатка Excel нет в Microsoft Word.
Возврат действий
Кнопка Вернуть (расположена справа от кнопки Отменить на панели быстрого доступа), по существу, отменяет команду Отменить. Если вы отменили слишком много действий, то можете нажать кнопку Вернуть (либо нажмите Ctrl+Y или F4 ) для возврата команд, которые были отменены.
Повтор действий
Вы можете повторять многие операции, нажимая Ctrl+Y или F4 . Эта команда просто повторяет последнее действие. Однако если последней операцией была операция Отменить, то результат ее действия отменяется (как описано в предыдущем разделе).
Повторение команд может быть полезно в плане экономии времени. Приведу пример. Вы могли применить множество настроек форматирования (задать размер шрифта, полужирное начертание, цвет фона и рамки) для ячейки с помощью диалогового окна Формат ячеек. После закрытия диалогового окна можно легко установить аналогичные настройки форматирования для других ячеек или диапазонов, нажимая Ctrl+Y. Или нам может понадобиться вставить пустые строки в определенных местах листа. Для этого выполните команду Главная → Ячейки → Вставить → Вставить строки на лист один раз , затем установите курсор в ячейку, в которую нужно вставить следующую строку, и нажмите Ctrl+Y , чтобы повторить команду вставки строки.
В Excel также есть кнопка Повторить , но обычно она недоступна. Несмотря на это, добавим ее на панель быстрого доступа.
- Щелкните правой кнопкой мыши на панели быстрого доступа и в появившемся контекстном меню выберите Настройка панели быстрого доступа . В результате откроется диалоговое окно Параметры Excel на вкладке Панель быстрого доступа .
- В раскрывающемся списке Выбрать команды из выберите пункт Часто используемые команды .
- В списке команд выберите Повторить .
- Нажмите кнопку Добавить , чтобы добавить выбранную команду на панель быстрого доступа.

- Нажмите ОК , чтобы закрыть диалоговое окно Параметры Excel .
Вы можете спросить, зачем вообще добавлять кнопку Повторить па панель быстрого доступа, если можно пользоваться сочетанием клавиш Ctrl+Y . Во-первых, при наведении указателя мыши на эту кнопку Excel отобразит описание повторяемой операции (рис. 6.2). Во-вторых, кнопка Повторить становится неактивной, если вы не можете повторить последнюю команду. — своеобразный визуальный сигнал, который поможет избежать ненужных попыток повторить то, что просто не может быть повторено.
К сожалению, функция повторения операции не всегда надежна. В некоторых случаях вы можете обнаружить, что нажатие Ctrl+Y не дает никакого эффекта (хотя должно). В других ситуациях нажатие Ctrl+Y может повторить команду, которую вы выполняли перед предыдущей командой.
Для всех, кто хоть раз сталкивался с необходимостью обработки изображения, известна программа Adobe Photoshop. Это приложение для работы с фотографиями, которое предлагает широкий функционал для внесения изменений. Редактор обладает множеством функций, поэтому новичкам не всегда понятно, как обратить действие.
Как применять горячие клавиши в фотошопе для отмены действия
Как отменить действие в фотошопе cs6 или cs5? Одна из самых главных и полезных функций Photoshop – возврат действия на клавиатуре, которая позволяет сделать шаг назад при обработке. Это можно осуществить несколькими способами, но самым простым остается сочетание горячих клавиш. С их помощью можно аннулировать изменение, которое внесли в программе, нужно запомнить простую комбинацию клавиш – Ctrl+Z. Если нажать ее повторно, то отмененные изменения вернутся обратно.
Как отменить выделение в фотошопе
Некоторые инструменты программы требуют выделения определенной области на слое. Не всегда получается с первого раза обвести правильно контур или участок фотографии, поэтому нужно знать, как снимать выделение с картинки. Варианты для решения проблемы:
Варианты для решения проблемы:
- Самый простой вариант – через последовательность клавиш Ctrl+D. После их нажатия рамка пропадет. Если зажать их повторно, появится контур всего слоя.
- Многие инструменты снимают выделение при нажатии правой кнопкой мыши на любой области изображения. Единственный нюанс – «Быстрое выделение» среагирует правильно, если нажимать внутри участка.
- Можно воспользоваться контекстным меню, для этого кликните по изображению правой кнопкой и найдите в списке раздел «Отменить выделение». В разных версиях программы и даже инструментах расположение этого пункта может отличаться (где-то на первом месте, а где-то в середине).
- Еще один вариант – перейдите на пункт меню «Выделение», который расположен на панели управления, нажимайте «Отменить выделение».
Как отменить последнее действие в фотошопе
При совершении случайной ошибки или получении результата, которого не ожидали, полезно будет знать, как отменить действие в фотошопе cs5 или cs6. Для этого можно воспользоваться командой горячих клавиш или меню программы. Чтобы вернуть последние изменения:
- В главном меню Photoshop нажмите на раздел «Edit». Выпадет меню, нужно нажать строчку, которая начинается с «Undo», а заканчивается названием примененного инструмента или правки. Это помогает понять, что будет изменено.
- Последовательность клавиш Ctrl+Z вернет вас на шаг назад, удалит последнее применение инструмента.
- В правом столбце найдите раздел под названием «History» (в русской версии «История»). Здесь будут отображены все сделанные вами операции (как правило, последние 20). Кликните на предпоследнюю строчку, это вернет вашу работу в Photoshop к состоянию на шаг назад. Иногда это окошко или вкладка отключены, включить отображение можно через настройки меню рабочей области.
Как сделать шаг назад в фотошопе
Сочетание горячих клавиш Ctrl+Z помогает только с последним изменением, но не имеет возможности возвращаться больше, чем на один шаг. Для этого нужно применять комбинацию Ctrl+Alt+Z. При многократном нажатии вы можете стереть последние правки над файлом на необходимое количество шагов назад. Если вам необходимо вернуться к более раннему состоянию документа, можно использовать и другой способ:
Для этого нужно применять комбинацию Ctrl+Alt+Z. При многократном нажатии вы можете стереть последние правки над файлом на необходимое количество шагов назад. Если вам необходимо вернуться к более раннему состоянию документа, можно использовать и другой способ:
- в главном меню перейдите на раздел «Edit»;
- найдите раздел «Step Backward»;
- нажмите необходимое количество раз.
Как отменить несколько действий в фотошопе
В некоторых случаях возвращение нужно сделать больше, чем на один шаг. Это может пригодиться, если вносили несколько изменений контрастности, палитры, проводили цветокоррекцию, добавляли яркость, но конечный результат вас не удовлетворил. Загружать заново картинку не хочется, особенно, если были уже внесены необходимые корректировки. Можно использовать варианты, как вернуться на несколько шагов назад:
- Для последовательной отмены нескольких правок вам необходимо в главном меню найти раздел «Edit» и нажать необходимое количество раз пункт «Step Backward». Нажимайте пункт столько раз, сколько правок нужно стереть.
- Точно такого же эффекта, как описано пунктом выше, можно добиться нажатием горячих клавиш Ctrl+Alt+Z. Пропадать внесенные правки будут в обратном порядке их применения. Будут удалены только те, которые были внесены на изображение, а выбор кистей, цвета останется прежним.
- Чтобы вернуться на несколько шагов назад в один клик, лучше использовать вкладку «История». Найдите это меню справа рабочей области программы (в англоязычной версии подписана «History»). По умолчанию этот список содержит 20 последних изменений, выберите необходимую точку восстановления и кликните на нее. Если перебросило слишком далеко, то нажмите строчку ниже и программа восстановит состояние. Этот вариант помогает удалить или вернуть любые необходимые правки.
Видео: отмена действия в фотошопе
Ошибочное действие в документе, созданном в MS Word, в меню «Правка» выберите команду «Отменить».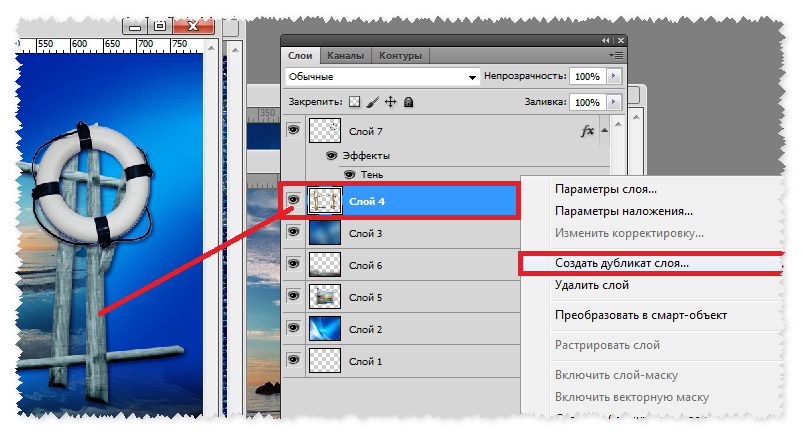 Этого же результата можно добиться, используя горячие клавиши Alt+Backspace. Если вы вдруг поняли, что действие было правильным, и зря вы его отменяли, примените сочетание Ctrl+Y.
Этого же результата можно добиться, используя горячие клавиши Alt+Backspace. Если вы вдруг поняли, что действие было правильным, и зря вы его отменяли, примените сочетание Ctrl+Y.
На панели быстрого доступа найдите кнопку «Отменить». Если требуется отменить сразу несколько действий, нажмите на стрелку вниз рядом с этой кнопкой, чтобы раскрыть список последних совершенных действий. При зажатой левой клавише мыши отметьте курсором ненужные операции и отпустите клавишу. Этого же результата можно добиться, используя сочетание клавиш Ctrl+Alt+Z.
Рядом с «Отменить» на панели быстрого доступа находится кнопка «Вернуть». Она возвращает удаленные шаги. Ее действие дублируется функциональной клавишей F4. Если кнопка «Отменить» не использовалась, «Вернуть» будет недоступна.
Для отмены действий в MS Excel также используется команда «Отменить» из меню правка, кнопка «Отменить» на панели быстрого доступа и сочетания клавиш Alt+Backspace и Ctrl+Z. Для возвращения ошибочно отмененных действий применяются те же средства, что и в MS Word.
В Adobe Photoshop в этой ситуации удобно использовать горячие клавиши Ctrl+Alt+Z и команду Step Backward («Шаг назад») из меню Edit («Редактирование»). Для возвращения ошибочно отмененного действия примените команду Step Forward («Шаг вперед») и сочетание Shift+Ctrl+Z.
Кроме стандартных клавиш и команд, в Photoshop есть удобная опция History («История»). Найдите ее в меню Window («Окно») и отметьте галочкой. Найдите на панели History ненужное действие , подцепите его мышкой и перетащите на значок корзины в нижней части панели. Чтобы отменить все изменения, щелкните по иконке изображения в самом верху списка.
Если вы произвели какие-то фатальные изменения в операционной системе, вернуть ее работоспособность вам поможет служба «Восстановление системы». Вызовите окно запуска программ сочетанием Win+R и введите в строку «Открыть» команду msconfig. Перейдите во вкладку «Сервис», отметьте в списке «Восстановление системы» и нажмите «Запустить». Выберите дату, наиболее близкую к той, когда были произведены ошибочные действия.
Выберите дату, наиболее близкую к той, когда были произведены ошибочные действия.
Источники:
- как вернуть действие назад
При работе в приложениях, редактирующих те или иные файлы, автоматически сохраняется определенное количество предыдущих шагов изменений файла. В некоторых случаях история сохраняется полностью, в других – только ее часть. Практически везде доступна функция восстановления первоначального состояния, однако при условии, что файл не сохранялся в процессе обработки.
Инструкция
Если вам нужно отменить последние , связанные с вводом и форматированием текста в редакторе, окне браузера и проч., для этого просто нажмите сочетание клавиш Ctrl+Z. Также в текстовом редакторе MS Office Word имеется специальная кнопка на панели инструментов, отвечающая за отмену последних изменений. Еще возможен вариант использования меню «Правка», «Отменить». В данном случае если ранее было произведено сохранение процесса редактирования документов, возврат на предыдущую позицию возможен.
Если вам нужно отменить последние изменения, связанные с редактированием изображений в программе Adobe Photoshop, воспользуйтесь сочетанием клавиш Alt+Ctrl+Z или нажмите на пункт меню «Редактирование», затем в выпадающем меню выберите «Шаг назад».
Если хотите полностью восстановить файл, нажмите F12. Если вы уже сохранили изменения, тогда их отмена будет невозможна. При редактировании графических файлов вообще лучше всего создавать и редактировать их копии, а оригиналы хранить отдельно. Также просмотрите историю изменений в специальной таблице изменений, которая доступно из пункта меню «Окно».
Если вы хотите отменить последние изменения, которые повлияли на работу компьютера (например, установка обновлений, программ, утилит), откройте меню «Пуск», выберите меню стандартных программ, затем «Служебные» и, наконец, «Восстановление системы». Перед вами на экране появится большое окно восстановления операционной системы, выберите на календаре программы контрольную точку сохранения параметров до произведения изменений в системе, выполните откат до этой даты.
Имейте в виду, что перед этим лучше всего сохранить личные данные, используемые вами при работе в приложениях, установленных за этот период, поскольку программы будут удалены вместе с ними. Это могут быть различные логины и пароли учетных записей, файлы ключей, ссылки и так далее.
Источники:
- как быть если тебе измении
При работе с изображениями в «Фотошопе » может потребоваться отменить предыдущее действие и вернуться к исходной картинке. Для возвращения к предыдущему результату нужно выполнить несколько действий..
Вам понадобится
- — компьютер;
- — любая версия программы «Фотошоп».
Инструкция
Работа с изображениями – увлекательное занятие, которое требует от фотомастера определенных знаний и умений. Но даже у опытного пользователя «Фотошопа» нередко возникают ситуации, когда в ходе работы над созданием нового шедевра нужно вернуться на несколько шагов назад.
Внести изменения в обрабатываемое фото можно на любом этапе редактирования. Правда, пред началом работы вам, естественно, нужно открыть изображение. Для этого достаточно одновременно нажать клавиши клавиатуры Alt+Shift+Ctr+O или в меню «Файл», что на рабочей панели, выбрать опцию «Открыть как», после чего указать место расположения изображения и его формат.
Далее приступайте к непосредственной обработке. А если потребуется внести изменения и вернуться назад, загляните в раздел «Редактирование» на рабочей панели. Здесь вы сможете произвести необходимые операции, выбрав соответствующую опцию: «Отменить», «Шаг назад» и «Шаг назад».
Для удобства вы можете воспользоваться «горячими клавишами»: Ctrl+Z – для отмены последнего действия, Shift+Ctrl+Z — для совершения шага вперед и Alt+Ctrl+Z – для выполнения шага назад.
Просмотреть всю историю изменений изображения в «Фотошопе » также можно, выбрав соответствующую операцию в меню «Окно» верхней панели. Отметьте галочкой пункт «История» в данном разделе, и в рабочем окне появится таблица, демонстрирующая все выполненные с картинкой действия.
Для отмены совершенных изменений на каком-либо этапе обработки изображения достаточно на экране «История» найти нужную операцию и вернуться к ней, кликнув по ней левой кнопкой мыши. В данном случае вы окажетесь именно на том шаге редактирования, на который укажете.
Если же вам нужно сохранить на фотографии все ранее произведенные действия, оставьте для себя черновой вариант изображения. Ведь он вам может еще понадобиться. А чтобы не запутаться , при сохранении придумайте ей название, по которому вы легко сориентируетесь во всех своих фотографиях, законченных и находящихся пока на стадии обработки.
Процедура отмены и удаления установленных обновлений операционной системы Microsoft Windows представляет из себя стандартную операцию, не требующую привлечения дополнительного программного обеспечения.
Инструкция
Вызовите главное системное меню, нажав кнопку «Пуск», и перейдите в пункт «Панель управления». Раскройте ссылку «Программы» и разверните узел «Просмотр установленных обновлений» в разделе «Программы и компоненты». Найдите подлежащее удалению обновление в списке открывшегося диалогового окна и вызовите его контекстное меню кликом правой кнопки мыши. Укажите команду «Удалить» и нажмите кнопку «Да» в открывшемся окошке запроса системы. Дождитесь завершения процесса.
Если речь идет об обновлении SP3 для Windows XP, воспользуйтесь возможностью удаления в скрытой системной папке $NTServicePackUninstall$. Для этого вернитесь в главное меню «Пуск» и перейдите в диалог «Выполнить». Напечатайте
имя_диска:\windows\$NTServicePackUninstall$\spuninst.exe
в строке «Открыть» и запуск утилиты мастера удаления пакета обновления, нажав кнопку OK. Подтвердите выполнение выбранного действия, нажав кнопку «Далее» в главном окне мастера и выполните все его рекомендации.
Одним из наиболее распространенных способов отмены установленного обновления можно считать использование функции восстановления прежнего состояния системы. Для применения данного способа удостоверьтесь в том, что компьютер был перезагружен хотя бы один раз после установки обновления и вызовите главное системное меню, нажав кнопку «Пуск». Перейдите в диалог «Выполнить» и напечатайте
Для применения данного способа удостоверьтесь в том, что компьютер был перезагружен хотя бы один раз после установки обновления и вызовите главное системное меню, нажав кнопку «Пуск». Перейдите в диалог «Выполнить» и напечатайте
%systemroot%\System32\restore\rstrui.exe
в строке «Открыть». Подтвердите запуск утилиты, нажав кнопку OK, и укажите опцию «Восстановление более раннего состояния компьютера» в открывшемся диалоговом окне. Подтвердите выполнение выбранного действия, нажав кнопку «Далее», и выберите желаемую дату для отката системы. Сохраните сделанные изменения, нажав кнопку «Далее» и выполните все рекомендации мастера восстановления. Перезагрузите компьютер для применения сделанных изменений.
Источники:
- Удаление пакета обновления SP3 для Windows XP
- как отменить установленные обновления
Редактор Adobe Photoshop является мощным инструментом обработки цифровых изображений. Это средство для решения профессиональных задач. Вследствие ориентированности на профессиональную среду, Photoshop не славится простотой. Поэтому у новичков, использующих Photoshop, возникает масса вопросов. Один из первых, пожалуй, будет о том, как отменить в фотошопе сделанные изменения.
Вам понадобится
- Графический редактор Adobe Photoshop.
Инструкция
Отмените последнее совершенное действие . Для этого выберите в главном меню приложения пункт «Edit». В раскрывшемся выпадающем меню кликните на пункт, название которого начинается со «Undo». Название данного пункта из слова «Undo» со следующим за ним названием последнего примененного инструмента или совершенного действия. Поэтому всегда можно видеть, какая операция будет отменена. Вместо выбора указанного пункта меню, можно нажать сочетание Ctrl+Z. Следует помнить, что данная операция производит отмену только
7 Декабрь 2013 Владимир Главная страница » Твой компьютер Просмотров: 32001Здравствуйте друзья. Рад приветствовать всех вас на страницах блога Spectr-rv.ru. Сегодня я хочу рассказать начинающим пользователям о том, как можно отменить последнее действие при работе на компьютере. Речь идет о сочетании клавиш Ctrl+Z. С помощью данной комбинации можно легко и просто отменить последнюю выполненную операцию.
Отмена последнего действия (комбинация Ctrl+Z) может быть очень полезной во многих случаях. Например, второпях, вы переместили файл не туда, куда следует. Или переместили файл, вместо того, чтобы его скопировать. Или удалили один файл вместо другого.
Можно, конечно, разыскать неправильно перемещенный файл и вернуть его на место. Можно, также, найти удаленный по ошибке материал в корзине и восстановить его. Но гораздо проще нажать клавиши Ctrl+Z.
По этой комбинации возвращается на свое место все неправильно перемещенное и восстанавливается все ошибочно удаленное. Отменив последнее действие (сочетание клавиш Ctrl+Z), можно, также, возвратить первоначальное имя файлу, если вы неверно его переименовали.
Препятствием для восстановления удаленного файла с помощью клавиш Ctrl+Z, может послужить очистка корзины, произведенная после выполнения неправильной команды. А также, невозможно подобным образом восстановить файл, безвозвратно удаленный по команде Shift+Del.
В текстовых и графических редакторах аналогом команды Ctrl+Z является кнопка с изогнутой стрелкой, показанная на приведенном ниже рисунке.
Отмена последнего действия в Paint
Вот и все, что я хотел рассказать о том, как можно отменить последнее действие, если его результат вас чем-то не устраивает. Вы узнали, что самый простой способ – это использовать сочетание клавиш Ctrl+Z. Надеюсь, статья вам понравилась. Удачи!
С уважением, Владимир (Spectr-rv.ru).
spectr-rv.ru
Как отменить действие на компьютере
Любой пользователь, который выполняет определенную работу на компьютере, может столкнуться с необходимостью отменить последнее действие. Причины такой отмены могут быть разнообразные, например, не верно введенная информация или выбрано действие. В разных программах и компонентах отмена последнего действия может отличаться.
Инструкция
Видео: Как отменить последнее действие на Windows 7!
besthard.ru
Как отменить последнее действие на компьютере? Восстановление операционной системы
Практически каждый пользователь сталкивался с такой ситуацией, когда определенные действия, выполненные на компьютере, вместо ожидаемого результата наносят вред, и хочется понять, как отменить последнее действие на компьютере. К примеру, это может быть скачивание различных программ, которые были заражены вирусами или что-либо еще.
В Microsoft давным-давно поняли, что главным врагом компьютера и операционной системы является далеко не какой-нибудь хакер или же еще какой-то злоумышленник, а сам пользователь, потому что именно своими действиями люди чаще всего приводят свои устройства в неисправность. Именно поэтому была введена функция того, как отменить последнее действие на компьютере, и называется она «Восстановление операционной системы».
Что это?
Восстановление операционной системы – это функция, позволяющая вам откатить компьютер на определенную дату, когда осуществлялось сохранение его характеристик и данных. При этом стоит отметить, что сохраняться эти данные могут как автоматически, так и вручную пользователем, в зависимости от того, как именно была настроена данная функция.
Преимуществом данного способа является то, что он позволяет полностью убрать все негативные действия, которые вы выполняли на своем компьютере за определенное время. Но, рассматривая, как отменить последнее действие на компьютере, его использовать часто не получается, потому что оно отменяет одновременно несколько действий, совершенных на компьютере, вне зависимости от того, несли ли они в себе вред.
Автоматически и вручную
Как говорилось выше, сохраняться система может как вручную пользователем, так и автоматически. В профессиональных кругах это называется «сохранение бэкапа», и делать его нужно обязательно, так как отменить последнее действие на компьютере без него невозможно.
Чтобы это настроить в Windows 7, нужно перейти по пути: «Панель управления» > «Восстановление» > «Восстановление файлов» > «Настроить резервное копирование». Здесь нужно будет выбрать основные параметры и запустить архивирование. В частности, вы можете самостоятельно выбрать, сохранять только определенные папки или же вовсе предоставить выбор папок операционной системе для того, чтобы в первую очередь ею сохранялась наиболее важная информация.
Что выбрать?
Преимуществом автоматического копирования является удобство, но для него нужно выделять большое количество свободного места на жестком диске, да и нередко оно не подходит, так как отменить все действия на компьютере за последний день еще можно, но вот за месяц или неделю уже сложнее.
Именно поэтому рекомендуется проводить архивацию исключительно вручную. В частности, это особенно рекомендуют специалисты для Windows 8, так как отменить последние действия на компьютере Windows 8 требуется в основном более часто. Чтобы ее настроить в этой системе, нужно будет через «Панель управления» перейти в раздел «Архивация и восстановление», после чего выбрать «Создание образа системы» и выполнить все указания мастера.
Восстановление данных тоже важно
Стоит отметить, что, помимо всего прочего, резервное копирование является крайне рекомендованным, если вы храните на компьютере какую-то важную информацию. Таким образом, если произойдет какая-то неполадка в процессе работы вашего оборудования, и вы потеряете все хранящиеся на винчестере данные, резервная копия позволит вам предельно быстро вернуть любые нужные вам файлы всего за несколько минут без привлечения специалистов со стороны, что сэкономит вам не только нервы и время, но и деньги.
fb.ru
Как отменить последние действия на компьютере
Работая за компьютером, каждый пользователь иногда совершает ошибочные действия, которых хотелось бы тут же отменить. К счастью, это не является проблемой и есть одна замечательная функция, которая может вам в этом помочь.
В большинстве программ имеется команда «Отменить», которая отменяет последние действия или изменения в текущем проекте. Если последним действием было добавление или вставка текста в документ, то с помощью команды вы можете отменить/удалить и вернуться к исходному варианту. Если последним изменением было удаление чего-либо, соответственно вы можете это восстановить. Также это может пригодиться тогда, когда вы случайно переписали большой кусок документа. В самом деле, знание и использование данной функции является большим облегчением для многих пользователей.
Функция Отменить чаще всего встречается в меню Редактирование или Правка.
Во многих программах есть кнопка Отменить на панели инструментов, которая обычно напоминает изогнутую стрелку, указывающую влево, такой как в документах Google или Word.
Аналогично вы можете нажать сочетание клавиш Ctrl+Z (или Command+Z на Mac) для отмены последних действий на компьютере.
Как правило, некоторые программы с помощью функции Отменить отслеживают не только самые последние действия, но и целый ряд (историю) последних изменений. Например, вы вставили картинку в документ и ввели текст поверх картинки, а затем однократно использовали команду отменить – то это отменяет самое последнее действие. То есть в данном примере вы удалите текст поверх картинки, который вы набрали, а использование команды второй раз – вы удалите картинку, которую вы вставили. Имейте в виду, что история изменений сохраняется только тогда, пока программа открыта. Если вы закроете документ (вне зависимости от того, сохранили вы его или нет) и откроете его снова, вы не сможете отменить предыдущие действия.
Во многих программах также имеется функция «Повторить» (или «Вперед»), которая возвращает то, что вы отменили с помощью команды «Отменить».
Данные команды используется почти во всех существующих программах, в том числе текстовых редакторах, графических редакторах, почтовых клиентах, программы управления файлами и т.д. Это является универсальными функциями в области компьютерного программного обеспечения. Как только вы привыкнете использовать эти полезные команды, вам больше не нужно будет беспокоиться об испорченной работе из-за простых ошибок.
Что такое компьютер и виды компьютеров
composs.ru
Отмена последнего действия в Microsoft Word
Если вы малоопытный пользователь компьютера, и вам по тем или иным причинам приходится часто работать в MS Word, наверняка, вам будет интересно знать о том, как в этой программе можно отменить последнее действие. Задача, на самом деле, довольно простая, а ее решение применимо для большинства программ, не только для Ворда.
Урок: Как в Word создать новую страницу
Существует, как минимум, два метода, с помощью которых можно отменить последнее действие в Ворде, и о каждом из них мы расскажем ниже.
Отмена действия с помощью комбинации клавиш
Если вы во время работы с документом Microsoft Word допустили ошибку, выполнили действие, которое необходимо отменить, просто нажмите на клавиатуре следующую комбинацию клавиш:
Это отменит последнее выполненное вами действие. Программа запоминает не только последнее действие, но и те, что ему предшествовали. Таким образом, нажав “CTRL+Z” несколько раз, вы сможете отменить несколько последних действий в порядке, обратному очереди их выполнения.
Урок: Использование горячих клавиш в Ворде
Также, для отмены последнего действия можно использовать клавишу “F2”.
Примечание: Возможно, перед нажатием “F2” потребуется нажать клавишу “F-Lock”.
Отмена последнего действия с помощью кнопки на панели быстрого действия
Если комбинации клавиш — это не для вас, и вы больше привыкли орудовать мышкой, когда требуется выполнить (отменить) то или иное действие в Word, тогда вас явно заинтересует метод, описанный ниже.
Для отмены последнего действия в Ворде нажмите фигурную стрелку, повернутую влево. Расположена она на панели быстрого доступа, сразу за кнопкой сохранения.
Кроме того, нажав на небольшой треугольник, расположенный справа от этой стрелочки, вы сможете увидеть список из нескольких последних действий и, если это необходимо, выбрать в нем то, которое вы хотите отменить.
Возврат последних действий
Если вы по какой-то причине отменили не то действие, не расстраивайтесь, Word позволяет отменить отмену, если это можно так назвать.
Чтобы повторно выполнить действие, которое вы отменили, нажмите следующую комбинацию клавиш:
Это вернет отмененное действие. Для аналогичных целей можно использовать и клавишу “F3”.
Закругленная стрелочка, расположенная на панели быстрого доступа справа от кнопки “Отмена”, выполняет аналогичную функцию — возврат последнего действия.
Вот, собственно, и все, из этой небольшой статьи вы узнали, как отменить последнее действие в Ворде, а значит, всегда сможете вовремя исправить допущенную ошибку.
Мы рады, что смогли помочь Вам в решении проблемы.
Иконка |
Клавиши |
Результат |
Result |
|
Shift + Ctrl + X |
Вызов панели «Пластика» |
Liquify toolbox |
W |
Деформация |
Forward Warp tool |
|
R |
Реконструировать |
Reconstruct tool |
|
C |
Скручивание по часовой стрелке |
Twirl Clockwise tool |
|
S |
Втягивание |
Pucker tool |
|
B |
Раздувание |
Bloat tool |
|
O |
Смещение пикселов |
Push Left tool |
|
M |
Отражение |
Mirror tool |
|
T |
Турбулентность |
Turbulence tool |
|
F |
Заморозка маски |
Freeze Mask tool |
|
D |
Разморозка маски |
Thaw Mask tool |
|
H |
Рука |
Hand tool |
|
Z |
Масштаб |
Zoom tool |
|
|
Tab |
Переключение между элементами управления справа, начиная с верхнего |
Cycle through controls on right from top |
|
Shift + Tab |
Переключение между элементами управления справа, начиная с нижнего |
Cycle through controls on right from bottom |
Пробел |
Временный выбор инструмента «Рука» |
Temporarily activate Hand tool |
|
|
Alt |
Замена кнопки «Отмена» на кнопку «Восстановить» |
Change Cancel to Reset |
|
] или [ |
Изменение размера кисти |
Decreases or increases brush size |
|
Alt + инструмент |
Изменение направления действия инструментов «Раздувание», Втягивание», «Смещение пикселов» и |
Reverse direction for Bloat, Pucker, Push Left, and Mirror tools |
|
Alt + применение различных режимов реконструкции |
Непрерывное измерение искажения |
Continually sample the distortion |
|
стрелки вверх или вниз при активном окне одного из параметров инструментов |
Увеличение или уменьшение цифровых значений параметров инструментов, если удерживать Shift, то изменения будут на десятки |
Decrease/increase brush size by 2, or density, pressure, rate, or turbulent jitter by 1 |
|
стрелки влево или вправо при активном слайдере одного из параметров инструментов |
Увеличение или уменьшение цифровых значений параметров инструментов, если удерживать Shift, то изменения будут на десятки |
Decrease/increase brush size by 2, or density, pressure, rate, or turbulent jitter by 1 |
|
Ctrl + Z |
Повторение последнего действия |
Redo last step |
| Применить настройки автотона | CTRL+U |
| Сбросить настройки тоновой коррекции | CTRL+R |
| Отмена/возврат последнего действия | CTRL+Z |
| Отмена нескольких последовательных действий | CTRL+ALT+Z |
| Возврат нескольких последовательных действий | CTRL+SHIFT+Z |
| Сброс всех настроек | ALT+ клик Сбросить |
| Открыть изображение в Photoshop | CTRL+O |
| Открыть без обновления метаданных | CTRL+ALT+O |
| Открыть как смарт-объект | SHIFT+CTRL+O |
| Сохранить с выбором параметров | CTRL+S |
| Сохранить без диалога | CTRL+ALT+S |
| Увеличить масштаб | CTRL + plus |
| Уменьшить масштаб | CTRL+ minus |
| Масштаб 100% | CTRL+ALT+0 (ноль) |
| Масштаб по рабочему окну | CTRL+0 (ноль) |
| Временное переключение на увеличение масштаба | CTRL+ клик |
| Временное переключение на уменьшение масштаба | ALT+ клик |
| Временное переключение на инструмент Рука | Пробел |
| Временный выбор пипетки Баланса белого | SHIFT |
| Переключение между панелями | CTRL+ALT+ № панели |
| Инструмент Масштаб | Z |
| Инструмент Рука | H |
| Инструмент Баланс белого | I |
| Инструмент Цветовой эталон | S |
| Инструмент целевой корректировки (ЦК) | T |
| ЦК параметрической кривой | CTRL+ALT+SHIFT+T |
| ЦК цветового тона | CTRL+ALT+SHIFT+H |
| ЦК насыщенности | CTRL+ALT+SHIFT+S |
| ЦК светимости | CTRL+ALT+SHIFT+L |
| ЦК смешения в градациях серого | CTRL+ALT+SHIFT+G |
| Инструмент Рамка | C |
| Инструмент Выпрямление | A |
| Инструмент Удаление точек | B |
| Инструмент Красные глаза | E |
| Инструмент Корректирующая кисть | K |
| Инструмент Градуированный фильтр | G |
| Инструмент Радиальный фильтр | J |
| Окно настроек | CTRL+K |
| Поворот на 90° влево | L |
| Поворот на 90° вправо | R |
| Предпросмотр | P |
| Полноэкранный режим | F |
| Просмотр отсечки в светах | O |
| Просмотр отсечки в тенях | U |
| Просмотр отсечки при регулировке тона | ALT + регулировка |
| Предпросмотр при настройке резкости | ALT + регулировка |
| Предпросмотр при настройке Разбиения тонов | ALT + регулировка |
| Предпросмотр при настройке Уменьшения шума | ALT + регулировка |
| Предпросмотр при настройке Удаления хроматических аберраций | ALT + регулировка |
| Уменьшение размера кисти | [ (левая квадратная скобка) |
| Увеличение размера кисти | ] (правая квадратная скобка) |
| Показать наложение (инструменты локальной коррекции) | V |
| Создать кисть или градиент с новыми настройками | N |
| Временное переключение на ластик | ALT |
| Рисование прямых линий кистью | Удерживать SHIFT |
| Протянуть градиент под углом c шагом 15° | Удерживать SHIFT |
| Скопировать градиент с теми же настройками | ALT+CTRL + перетаскивание мышью |
| Выровнять радиальный градиент по краям изображения | CTRL+ двойной клик внутри градиента |
| Настройка размера кисти | Перетаскивание с нажатой ПКМ |
| Настройка жесткости кисти | Перетаскивание с нажатой ПКМ и SHIFT |
| Показать маску (инструменты локальной коррекции) | Y |
| Добавить точку на кривую из изображения | CTRL + клик на участке изображения |
| Отменить выделение точек на кривой | D |
| Выделить несколько точек на кривой | SHIFT + клики по точкам |
| Перемещение точки на один тоновый уровень | Стрелки на клавиатуре |
| Перемещение точки на 10 тоновых уровней | SHIFT + стрелки на клавиатуре |
| Переключение между точками | Plus и Minus |
| Удаление точки с кривой | CTRL + клик по точке |
| Регулировка Температуры на 50К (при активном регуляторе) | Стрелки вверх и вниз |
| Регулировка температуры на 500К | SHIFT + стрелки вверх и вниз |
| Регулировка Оттенка Баланса Белого на 1 градацию | Стрелки вверх и вниз |
| Регулировка Оттенка Баланса Белого на 10 градаций | SHIFT + стрелки вверх и вниз |
| Настройка остальных регуляторов с минимальным шагом | Стрелки вверх и вниз |
| Настройка остальных регуляторов с увеличенным шагом | SHIFT + стрелки вверх и вниз |
Новые возможности Photoshop версии 2018 (20.0) | GraphiCC.ru
В Photoshop версии 2018 (20.0) появились новые полезные функции для дизайнеров, цифровых фотографов и иллюстраторов. В этом разделе предлагается краткое описание этих функций и приводятся ссылки на дополнительные сведения.
Инструмент «Кадр» для применения масок Без труда маскируйте изображения, помещая их в рамки. Используйте Инструмент «Кадр» (К), чтобы быстро создавать прямоугольные или овальные рамки-местозаполнители. Также можно превратить любую фигуру или текст в рамки и заполнять их изображениями.
Чтобы поместить изображение в рамку, просто перетащите ресурс Adobe Stock или ресурс библиотеки с панели «Библиотеки» или с локального диска. Изображение автоматически масштабируется по размеру рамки. Содержимое, которое помещается в рамки, всегда добавляется в виде смарт-объектов, что обеспечивает возможность обратимого масштабирования.
Подробные сведения см. в разделе Помещение изображений в кадры.
Усовершенствована функция заливки с учетом содержимого
На базе технологии Adobe SenseiНовая специальная рабочая среда «Заливка с учетом содержимого» обеспечивает возможность интерактивного редактирования для получения идеальной заливки. Теперь можно выбрать, какие исходные пиксели использовать, а затем поворачивать, масштабировать и отражать с использованием технологии Adobe Sensei. Также поддерживается предварительный просмотр изменений в полном разрешении прямо во время работы и сохранение результатов на новый слой.
Запуск рабочей среды «Заливка с учетом содержимого»
Откройте изображение в Photoshop. С помощью любого инструмента выделения создайте первоначальную область, которую требуется залить.
В строке меню выберите Изменить > Заливка с учетом содержимого.
В окне документов внутри этой рабочей среды отображается область пробы по умолчанию. Она имеет вид наложенной маски внутри изображения. Изменить область пробы и исходную область для заливки можно с помощью инструментов на панели «Инструменты» (в левой части экрана). На панели «Заливка с учетом содержимого» (в правой части экрана) можно указать параметры области пробы, а также настройки заливки и вывода, чтобы получить желаемый результат заливки. По мере внесения изменений итоговый результат будет сразу отображаться на панели «Просмотр» в полном разрешении.
Подробные сведения см. в разделе Удаление объектов с фотографий с помощью функции «Заливка с учетом содержимого».
Новый режим многократной отмены
Теперь можно использовать сочетания клавиш «Control + Z» (Win) / «Command + Z» (Mac) для отмены нескольких действий в документе Photoshop, совсем как в других приложениях Creative Cloud. Новый режим многократной отмены по умолчанию включен.
При включенном режиме многократной отмены в меню Редактирование отображаются следующие команды:
Отменить: перемещает на шаг назад по цепочке отмен. Используйте сочетания клавиш: «Control + Z» (Win) / «Command + Z» (Mac).
Повторить: перемещает на шаг вперед. Используйте сочетания клавиш: «Shift + Control + Z» (Win) / «Shift + Command + Z» (Mac).
Переключить последнее состояние работает так же, как и в прежнем режиме. Используйте сочетания клавиш: «Alt + Z» (Win) / «Command + Z» (Mac).
Как вернуть устаревшие сочетания клавиш отмены?
В меню «Редактирование», рядом с командами «Отменить» и «Повторить», также отображается название шага, который будет отменен.
Например, Редактирование > Отменить редактирование текста.
Команды Шаг вперед и Шаг назад удалены из меню Редактирование. Эти команды по-прежнему доступны во вспомогательном раскрывающемся меню на панели История. Кроме того, теперь по умолчанию можно отменять изменения видимости слоя. При щелчке значка видимости на панели Слои создается состояние на панели «История». Это поведение можно изменять с помощью параметра Включить отмену для изменения видимости слоев в диалоговом окне Параметры палитры «История», которое можно открыть с помощью дополнительного раскрывающегося меню панели История.
Другие полезные сведения по этой теме см. в разделе Отмена операций и панель «История».
Улучшения для удобства использования
Контрольная точка по умолчанию скрыта
Трансформируя объекты, теперь можно с легкостью перемещать их на холсте. Контрольная точка, которая раньше появлялась при трансформировании объектов, теперь по умолчанию скрыта. Можно установить флажок Переключить контрольную точку на панели «Параметры», если требуется отобразить контрольную точку.
Дополнительные сведения см. в разделе Установка или перемещение контрольной точки для трансформирования.
Двойной щелчок для редактирования текста
Теперь можно дважды щелкнуть текстовый слой инструментом «Перемещение», чтобы быстро приступить к редактированию текста в документе. Теперь для редактирования текста больше не требуется переключать инструменты.
Дополнительные полезные сведения по теме см. в разделе Редактирование текста.
Автоприменение
Эффективно обрезайте, трансформируйте и размещайте или вводите текст с помощью функции автоприменения. Теперь для применения изменений больше не требуется нажимать клавишу ВВОД (Windows)/RETURN (macOS) или нажимать кнопку «Применить» на панели «Параметры».
В процессе кадрирования или трансформирования выполните одно из следующих действий для автоматического применения изменений.
Выберите новый инструмент.
Щелкните слой на панели «Слои». (Это действие автоматически применяет изменения и выбирает слой.)
Щелкните область за пределами холста в окне документа.
Щелкните область за пределами ограничительной рамки на холсте.
При вводе текста на текстовом слое выполните любое из следующих действий для автоматического применения изменений.
Выберите новый инструмент.
Щелкните слой на панели «Слои». (Это действие автоматически применяет изменения и выбирает слой.)
Дополнительную полезную информацию по теме см. в следующих разделах:
Трансформирование объектов
Трансформирование изображений, фигур и контуров
Редактирование текста
Пропорциональное трансформирование по умолчанию
Теперь Photoshop трансформирует большинство типов слоев (в том числе пиксельные, текстовые слои, слои-фигуры, растровые изображения, размещенные смарт-объекты) пропорционально по умолчанию. Фигуры и траектории, являющиеся векторами, по-прежнему по умолчанию трансформируются без сохранения пропорций.
Теперь, чтобы сохранить пропорции слоя при трансформировании, больше не требуется удерживать клавишу «Shift» во время перетаскивания углового маркера для изменения размера выделенного слоя. При перетаскивании углового маркера во время трансформирования всегда выполняется пропорциональное изменение размера слоя. Теперь удержание клавиши «Shift» при перетаскивании углового маркера во время трансформирования приводит к непропорциональному изменению размера.
Чтобы пропорционально изменить размер слоя при трансформировании, выполните следующие действия.
Выберите слои, размер которых требуется изменить, на панели Слои.
Нажмите клавиши «Command + T» (Mac) / «Control + T» (Win). Или выберите Редактирование > Свободное трансформирование.
Перетащите угловой маркер ограничительной рамки, чтобы изменить размер слоя.
Примените изменения.
Как отключить пропорциональное масштабирование по умолчанию при трансформировании слоев?
Дополнительную полезную информацию по теме см. в следующих разделах:
Трансформирование объектов
Свободные трансформирования изображений, фигур и контуров
Предотвращение случайного перемещения панелей благодаря функции блокировки рабочей среды
Используйте новый параметр Заблокировать рабочую среду, чтобы предотвратить случайное перемещение панелей рабочей среды, в частности, при работе в Photoshop на планшете с пером. Для доступа к этому параметру выберите Окно > Рабочая среда > Заблокировать рабочую среду.
Параметр «Заблокировать рабочую среду» в Photoshop
Дополнительные полезные сведения о параметрах рабочей среды см. в разделе Основные сведения о рабочей среде.
Предварительный просмотр режима наложения в реальном времени
Теперь можно прокручивать разные варианты режима наложения, чтобы посмотреть, как они смотрятся на изображении. Photoshop в реальном времени показывает предварительный просмотр режимов наложения на холсте, при прокручивании разных вариантов режима наложения на панели Слои и в диалоговом окне Стиль слоя.
Прокручивание вариантов режима наложения на панели «Слои».
Дополнительную полезную информацию по теме см. в следующих разделах:
Непрозрачность и наложение слоев
Режимы наложения
Режим симметрии
Делайте мазки кистью, образуя идеально симметричный орнамент. При работе с инструментами «Малярная кисть», «Микс-кисть», «Карандаш» или «Ластик» щелкните значок «Бабочка» на панели «Параметры». Выберите один из доступных типов симметрии: Вертикальная, Горизонтальная, Двухосевая, Диагональная, Волнистая, Круговая, Спиральная, Параллельные линии, Радиальная или «Мандала». Во время рисования мазки в реальном времени отражаются по оси симметрии, что позволяет создавать замысловатые симметричные узоры.
Узор, созданный с использованием симметрии «Мандала». (Узор создан Майком Шоу (Mike Shaw).)
Подробные сведения см. в разделе Рисование симметричных орнаментов.
Цветовой круг для выбора цветов
Используйте цветовой круг для визуализации цветового спектра и быстрого выбора цветов на основе гармоний, таких как комплементарные и сходные цвета. В дополнительном раскрывающемся меню на панели Цвет выберите Цветовой круг.
Использование цветового круга для выбора цветов
Начальный экран
Вы можете быстро начать работу с Photoshop на Начальном экране. Переходите на начальный экран, чтобы узнавать о новых функциях, подключаться к обучающим ресурсам и быстро возвращаться в открытые документы. Вы можете в любой момент перейти на начальный экран, щелкнув значок«Начальный экран» напанели «Параметры».
Начальный экран Photoshop
Для получения дополнительной информации см. раздел Основные сведения о рабочей среде.
Улучшенное обучение в приложении
После завершения урока в приложении (панель Обучение) можно улучшать собственные изображения, затрачивая на это меньше времени.
Обучение с использованием изображений пользователя
Самые востребованные пользователями функции
Распределять расстояние (как в Adobe Illustrator)
Теперь можно распределять расстояние между объектами. Photoshop уже может распределять объекты, равномерно располагая их центральные точки. Если объекты разного размера, теперь их можно расположить на одинаковом расстоянии друг от друга. Дополнительные полезные сведения по этой теме см. в разделе Выравнивание и распределение слоев.
(Слева) Параметры распределения расстояния между объектами в Photoshop. (Справа) Расстояние между объектами распределено по горизонтали.
Математические действия в числовых полях
Также можно выполнять простые математические действия в любых полях для числовых значений. Например, теперь можно вводить простые математические операции, такие как «200/2», которые тут же вычисляются как 100, а в поле вводится окончательный результат. Это очень полезно, когда требуется быстро найти кратное определенного значения или разделить значение. Дополнительные сведения см. в разделе Используйте простые математические действия в числовых полях.
Изображение с простым математическим действием в диалоговом окне «Размер холста».
Возможность просмотра длинных имен слоев
Теперь для длинных имен слоев Photoshop сохраняет начало и окончание имени, а центральную часть заменяет троеточием (…). Раньше конец длинного имени слоя заменялся троеточием (…).
Теперь Photoshop ставит троеточие (…) в центре длинных имен слоев.
Функция «Подбор шрифта» теперь поддерживает японские шрифты
Теперь можно выполнять поиск японских шрифтов с помощью функции «Подбор шрифта». Благодаря Adobe Sensei функция «Подбор шрифта» позволяет определять текст, включенный в выделенную область изображения и подбирать к нему лицензированные шрифты на компьютере или шрифты Adobe, предлагая подобные шрифты. Дополнительные сведения см. в разделе Подбор шрифта.
Поиск японских шрифтов с помощью функции «Подбор шрифта».
Настройка для увеличения размера элементов интерфейса
Воспользуйтесь улучшенными функциями управления при масштабировании интерфейса Photoshop и настраивайте его независимо от других приложений, чтобы получить нужный размер шрифта. В окне «Установки интерфейса» (Редактирование > Установки > Интерфейс) появилась новая настройка Масштабировать интерфейс по размеру шрифта. При выборе этой новой настройки весь интерфейс Photoshop масштабируется на основе значения, выбранного в раскрывающемся списке Размер шрифта меню:Крошечный, Маленький, Средний или Большой.
Настройка «Масштабировать интерфейс по размеру шрифта» в установках интерфейса
Поддержка письменности Юго-Восточной Азии
Теперь Photoshop включает поддержку пяти новых языков Юго-Восточной Азии, так что в документы можно включать тексты на следующих языках: тайском, бирманском, лаосском, сингальском и кхмерском.
ПРИМЕЧАНИЕ.
Чтобы без проблем работать с этими языками в системе Windows, необходимо установить наборы шрифтов для языка, который требуется использовать. Подробные сведения см. в справочной документации Майкрософт: Языковые пакеты.
Чтобы создать документ на одном из этих языков, сделайте следующее.
Выберите «Редактирование» > «Установки» > «Текст».
Выберите параметр Языки Ближнего Востока и Юго-Восточной Азии.
Откройте любой документ.
Создайте текстовый слой.
На панели Символ выберите любой из новых языков: тайский, бирманский, лаосский, сингальский или кхмерский.
В зависимости от выбранного языка задайте соответствующий шрифт. Например, если выбран тайский язык, установите тайский шрифт, такой как Adobe Thai или Noto Sans Thai.
Скопируйте и вставьте текст на выбранном языке. Если настроена соответствующая раскладка клавиатуры, просто введите нужный текст.
Дополнительные сведения см. в разделе Компоновщики для азиатской письменности.
Модернизировано ядро композиции
В этом выпуске Photoshop реализован новый механизм композиции с более современной архитектурой, упрощающей оптимизацию на всех платформах (macOS, Windows и iOS/мобильные устройства).
механизмов стимулированного активином синтеза ФСГ: история свиньи и FOX1 | Биология размножения
Аннотация
Активиныбыли открыты и названы более четверти века назад на основании их способности стимулировать синтез и секрецию фолликулостимулирующего гормона (ФСГ) гипофиза. Однако только в последнее десятилетие мы наконец пришли к пониманию основных механизмов их действия в гонадотропных клетках. В этом мини-обзоре мы приводим хронику исследований, которые привели к недавнему открытию вилочного бокса L2 (FOXL2) как важного медиатора транскрипции регулируемой активином бета-субъединицы ( Fshb ) in vitro и in vivo.
Введение
Исследования между 1930-ми и 1980-ми годами установили, что нестероидный гормон, ингибин, из гонад может избирательно подавлять секрецию фолликулостимулирующего гормона (ФСГ) клетками гонадотрофов гипофиза, не влияя на лютеинизирующий гормон (ЛГ) (например, [1-7]) . Три группы (во главе с Вейлом, Гийемином и Робертсоном) впоследствии выделили два белка, ингибин А и ингибин В, из фолликулярной жидкости яичников, основываясь на их способности подавлять секрецию ФСГ из культур гипофиза крыс [8-10].Ингибины имеют общую субъединицу α (ингибин α), дисульфидную связь с одной из двух структурно связанных субъединиц β (ингибин βA или βB). В ходе своих исследований группы Vale и Guillemin сделали случайное наблюдение, что другие белковые фракции обладают противоположной активностью по сравнению с фракциями, содержащими ингибины, то есть они стимулируют высвобождение ФСГ, но не ЛГ из культивируемых клеток гипофиза [11, 12]. Последующая очистка ассоциированных белков выявила гомо- или гетеродимеры двух субъединиц ингибина β; то, что мы теперь называем активинами A, B и AB.Эти основополагающие открытия установили, что ингибины и активины, члены более крупного суперсемейства трансформирующих факторов роста β (TGFβ), являются инь и янь избирательной регуляции ФСГ.
Исследования 1990-х годов раскрыли основные механизмы передачи сигнала активинами и другими лигандами TGFβ через рецепторные серин / треонинкиназы и гомолог Drosophila матерей против декапентаплегических (SMAD) эффекторных белков [13, 14]. В 2000 году Вейл и его коллеги описали механизм действия ингибина посредством конкурентного антагонизма связывания рецептора активина и передачи сигналов [15].Хотя это открытие предполагало, что активины были настоящими драйверами системы, связь между активацией рецептора активина и секрецией ФСГ отсутствовала. Действительно, только в последние несколько лет мы наконец начали разгадывать молекулярные детали [16–18]. Здесь мы даем краткий исторический обзор исследования, которое, наконец, пролило свет на этот долгий неуловимый процесс.
Механическое понимание синтеза ФСГ: преодоление препятствий
Подобно другим членам семейства гликопротеиновых гормонов, ФСГ представляет собой гетеродимер, продуцируемый нековалентной ассоциацией общей субъединицы α гонадотропина (часто называемой αGSU, а в последнее время — хорионического гонадотропина α) и гормоноспецифической субъединицы β (ФСГβ или ФСГБ).Субъединица β придает лиганду биологическую специфичность, и ее синтез обычно считается ограничивающим скорость продуцирования зрелого гормона. Следовательно, понимание регулируемого активином синтеза и секреции ФСГ обязательно начинается с анализа регуляции транскрипции Fshb / FSHB . К сожалению, такому анализу в течение как минимум десяти лет препятствовали два важных препятствия. Во-первых, гонадотрофы, единственные клетки гипофиза, продуцирующие ФСГ, относительно редки (5–10% от общей популяции клеток передней доли гипофиза).Во-вторых, в течение многих лет требовалась подходящая гомологичная клеточная линия, но ее не было. Последнее препятствие было окончательно преодолено с разработкой иммортализованной линии гонадотропных клеток мышей, LβT2, Mellon et al. [19]. Клетки были получены из опухоли гипофиза трансгенной мыши, экспрессирующей большой Т-антиген SV40 под контролем промотора LHβ крысы. Они экспрессируют субъединицу LHβ, а также αGSU и другие маркеры гонадотрофов, включая рецептор гонадотропин-рилизинг-гормона (GnRH) и стероидогенный фактор 1 (SF1 или NR5A1) [19].Первоначальный анализ, однако, показал, что клетки LβT2 не обладают экспрессией FSHβ, что представляет собой еще одно очевидное препятствие на пути функциональных исследований синтеза FSH. Важно отметить, что Лоу и его коллеги обнаружили, что клетки LβT2 выделяют ФСГ и продуцируют мРНК Fshb , особенно при обработке активинами [20]. Это наблюдение открыло путь для механистических исследований синтеза ФСГ.
Активационная регуляция транскрипции FSHB: каноническая сигнализация
В течение нескольких лет после их открытия данные из нескольких лабораторий сошлись, чтобы показать, что активины стимулируют как экспрессию мРНК Fshb , так и стабильность [21–26].Более того, активин B, продукт гонадотрофов, возник как вероятная эндогенная форма лиганда, регулирующего синтез ФСГ [27]. Ранние попытки описать механизмы стимулированной активином транскрипции Fshb путем трансфекции промотора-репортеров Fshb в смешанные первичные культуры гипофиза и гонадотропоподобные клетки αT3-1 не увенчались успехом [21, 28, 29]. Важный прорыв произошел в 2001 году, когда лаборатории Меллона и Миллера показали, что проксимальный промотор (5′-фланкирующая последовательность) гена Fshb овцы придает базальную активность репортеру люциферазы в клетках LβT2, но не в других клеточных линиях [28] .Более того, экзогенный активин A дополнительно увеличивал репортерную активность, предполагая, что активины регулируют транскрипцию овец Fshb . Последующий анализ показал, что проксимальные промоторы Fshb крысы, мыши и свиньи сходным образом придают активин-индуцированную репортерную активность в этих клетках [29–34]. Интересно, что хотя промотор FSHB человека устойчиво отвечает на GnRH, он слабо индуцируется активинами в клетках LβT2 [35–37]. Отражает ли это истинное межвидовое различие в чувствительности к активину или, скорее, ограничения этой модели in vitro для понимания регуляции человеческого гена, в настоящее время неясно.Однако примечательно, что экспрессия минигена человеческого FSHB в гонадотрофах трансгенных мышей требует последовательностей как 5′-сайта начала транскрипции, так и 3′-кодона терминации трансляции [38]. Несмотря на это, как более подробно описано ниже (см. История свиньи и FOX ), оценка межвидовых различий в активности промотора-репортера Fshb / FSHB в клетках LβT2 привела к важному прогрессу в нашем понимании активина. -регулируемая транскрипция Fshb [32].
Как упоминалось выше, общий механизм передачи сигнала, опосредованного активином, был описан ранее [13, 14]. Это послужило отправной точкой для более глубоких и систематических анализов регулируемой активином экспрессии Fshb (Fig. 1). Как правило, димерные активины связывают комплексы серин / треониновых киназ рецепторов типа I / типа II. При связывании лиганда рецепторы типа II фосфорилируют рецепторы типа I, которые, в свою очередь, фосфорилируют сигнальные белки семейства SMAD, в частности SMAD 2 и 3.Эти регулируемые рецептором SMAD взаимодействуют с кофактором SMAD4, накапливаются в ядре и регулируют транскрипцию гена-мишени. SMAD3 и SMAD4 (но не полноразмерный SMAD2) могут связываться с ДНК напрямую через минимальный SMAD-связывающий элемент (SBE), GTCT или его обратный комплемент (AGAC) [39–41]. Однако этот элемент является обычным в геноме и связывает SMAD с низким сродством [42]. Таким образом, специфичность активации SMAD генов-мишеней, по-видимому, происходит из партнерства с кофакторами, которые связывают цис- -элементов в непосредственной близости от SBE [43].
Рис. 1
Схематическое изображение регулируемой активином экспрессии субъединицы Fshb мыши. Димерные активины связываются с серин-треонинкиназами рецептора типа II, такими как ACVR2A. Рецепторы типа I, такие как ALK4 или ALK7, затем вовлекаются в комплекс и транс -фосфорилируются (обозначены буквой P в круге) рецепторами типа II. Затем активированные рецепторы I типа фосфорилируют и активируют внутриклеточные сигнальные белки SMAD2 и SMAD3.Эти SMAD сотрудничают с co-SMAD, SMAD4, и накапливаются в ядре. Комплексы SMAD регулируют промотор с помощью различных механизмов. Например, SMAD2-SMAD3-SMAD4 связывают SMAD-связывающий элемент (SBE) длиной 8 пар оснований в промоторах мыши (m) или крысы (r). SMAD также являются партнером гонадотропного / тиреотрофного фактора транскрипции FOXL2, чтобы регулировать транскрипцию Fshb . FOXL2 может связывать по крайней мере три различных элемента, связывающих вилку (FBE) в промоторе мыши. Из них проксимальный FBE3 является наиболее важным.SMAD4 связывает соседний SBE, а SMAD3, который взаимодействует как с SMAD4, так и с FOXL2 через свой C-концевой домен Mh3, связывает белки в единый комплекс. Неизвестно, участвует ли SMAD2 в этом комплексе. FBE3 (показан курсивом) консервативен в промоторах свиньи (p) и человека (h). Относительное положение соседнего SBE (подчеркнуто) немного отличается у разных видов. В промоторе Fshb свиньи второй FBE (соответствующий FBE2 на рисунке) с соседним SBE (не показан) является критическим для индукции его активина.Последовательность этого FBE отличается в одном или двух положениях (подчеркнутых) у свиньи, человека и мыши. Неизвестно, действительно ли FOXL2 связывает эту часть мышиного промотора. Третий FBE (FBE1) уникален для мышиного промотора. Хотя он связывает FOXL2, неясно, как и в какой степени этот сайт опосредует индукцию транскрипции активином. Консервативный сайт связывания PITX также участвует в ответе активина, но его механизм действия все еще требует уточнения.
Рис. 1
Схематическое изображение регулируемой активином экспрессии субъединицы Fshb мыши.Димерные активины связываются с серин-треонинкиназами рецептора типа II, такими как ACVR2A. Рецепторы типа I, такие как ALK4 или ALK7, затем вовлекаются в комплекс и транс -фосфорилируются (обозначены буквой P в круге) рецепторами типа II. Затем активированные рецепторы I типа фосфорилируют и активируют внутриклеточные сигнальные белки SMAD2 и SMAD3. Эти SMAD сотрудничают с co-SMAD, SMAD4, и накапливаются в ядре. Комплексы SMAD регулируют промотор с помощью различных механизмов.Например, SMAD2-SMAD3-SMAD4 связывают SMAD-связывающий элемент (SBE) длиной 8 пар оснований в промоторах мыши (m) или крысы (r). SMAD также являются партнером гонадотропного / тиреотрофного фактора транскрипции FOXL2, чтобы регулировать транскрипцию Fshb . FOXL2 может связывать по крайней мере три различных элемента, связывающих вилку (FBE) в промоторе мыши. Из них проксимальный FBE3 является наиболее важным. SMAD4 связывает соседний SBE, а SMAD3, который взаимодействует как с SMAD4, так и с FOXL2 через свой C-концевой домен Mh3, связывает белки в единый комплекс.Неизвестно, участвует ли SMAD2 в этом комплексе. FBE3 (показан курсивом) консервативен в промоторах свиньи (p) и человека (h). Относительное положение соседнего SBE (подчеркнуто) немного отличается у разных видов. В промоторе Fshb свиньи второй FBE (соответствующий FBE2 на рисунке) с соседним SBE (не показан) является критическим для индукции его активина. Последовательность этого FBE отличается в одном или двух положениях (подчеркнутых) у свиньи, человека и мыши. Неизвестно, действительно ли FOXL2 связывает эту часть мышиного промотора.Третий FBE (FBE1) уникален для мышиного промотора. Хотя он связывает FOXL2, неясно, как и в какой степени этот сайт опосредует индукцию транскрипции активином. Консервативный сайт связывания PITX также участвует в ответе активина, но его механизм действия все еще требует уточнения.
Описаны два рецептора активина типа II, ACVR2A и ACVR2B [44–46]. ACVR2A может быть более критичным из двух для продукции FSH, поскольку мыши с нокаутом Acvr2a имеют дефицит FSH [47].Таким образом, даже если он присутствует у гонадотрофов, ACVR2B, по-видимому, не компенсирует потерю ACVR2A in vivo. Acvr2b -нокаутные мыши умирают постнатально из-за сердечных дефектов и паттерна [48], что не позволяет оценить роль рецептора в синтезе ФСГ, по крайней мере, с использованием этой модели на животных. И ACVR2A, и ACVR2B экспрессируются в клетках LβT2 [28, 49, 50], но об их относительной роли в обеспечении индукции активина транскрипции Fshb не сообщалось. В суперсемействе TGFβ имеется семь рецепторов типа I (также называемых активиноподобными киназами или ALK).Активин A, по-видимому, передает сигналы исключительно через ALK4 (также известный как ACVR1B), тогда как активин B может передавать сигналы как через ALK4, так и через родственный ALK7 (ACVR1C) [51, 52]. Самки мышей с дефицитом ALK7 ( Acvr1c ) имеют сниженные уровни ФСГ во время диэструса, но это может отражать косвенный эффект делеции гена в яичнике [53]; не только яичники мышей с нокаутом Acvr1c обнаруживают нарушенные ответы на экзогенные гонадотропины, но и высвобождение ФСГ из их гипофизов в первичной культуре является нормальным как базовым, так и в ответ на экзогенные активины.ALK4 ( Acvr1b) -дефицитные мыши погибают во время эмбрионального развития [54]; следовательно, необходимость этого рецептора в синтезе ФСГ in vivo еще не установлена. Низкомолекулярный ингибитор ALK4, ALK5 и ALK7 (SB431542; [55]) отменяет индуцированную активином транскрипцию Fshb в клетках LβT2 [50, 56], но об относительной роли различных рецепторов не сообщалось. Конститутивно активные формы ALK4 и ALK7 эквивалентно и устойчиво индуцируют репортерную активность Fshb при трансфекции в клетки LβT2 [37, 51].Необходимы дополнительные исследования in vitro и in vivo для определения относительного вклада двух рецепторов в регулируемый активином синтез ФСГ. Недавняя разработка условных аллелей для Acvr1b [57, 58], допускающих делецию клеточно-специфичного гена, должна значительно облегчить такой анализ на мышах.
Используя подходы как сверхэкспрессии, так и нокдауна, Вудрафф и его коллеги установили роль SMAD3, но не SMAD2, в индукции активина промотора крысиного Fshb в клетках LβT2 [33, 59].Более того, они идентифицировали канонический SBE из 8 пар оснований (GTCTAGAC; [60]) (см. Рис. 1) в проксимальном промоторе, который необходим для полной индукции активности репортера Fshb крысы с помощью активинов. Эти данные были независимо подтверждены Kaiser и коллегами [31], и обе группы продемонстрировали синергетическую стимуляцию Fshb с помощью SMAD3 и SMAD4, когда эти два белка были сверхэкспрессированы в клетках LβT2. Как активин, так и SMAD-зависимая индукция репортерной активности мышиного Fshb зависит от сопоставимого SBE [35, 61].В отличие от крысиного промотора, SMAD2, помимо SMAD3, по-видимому, играет роль в индукции активина мышиного Fshb [29, 62]. Действительно, активин A стимулирует образование комплексов SMAD2-SMAD3-SMAD4, которые могут связывать SBE длиной 8 п.о. в промоторе мыши [35]. SMAD4 абсолютно необходим для индукции активином A транскрипции мышиного Fshb в клетках LβT2 и должен связываться с ДНК, чтобы опосредовать его эффекты [63].
В настоящее время существует немного опубликованных данных, говорящих об относительной роли белков SMAD в синтезе ФСГ in vivo.В одной модели дефицита Smad3 у мышей у взрослых самцов обнаружено 30% снижение уровней мРНК Fshb в гипофизе [64]. Однако уровни мРНК Lhb подавлены в аналогичной степени, поэтому неясно, является ли эффект делеции гена специфичным для передачи сигналов активина или отражает более общее нарушение функции или развития гонадотрофов (хотя см. [64, 65] ). У самок того же штамма (у которых экзон 8 гена удален) повышен уровень сывороточного ФСГ, но не ЛГ [66].Однако эти самки бесплодны и демонстрируют явный дефицит функции яичников [67]. Эти данные предполагают, что SMAD3 сам по себе может не требоваться для синтеза ФСГ in vivo, но о его специфической роли в регулируемом активином синтезе ФСГ на уровне гонадотрофов не сообщалось. Интересно, что самки из второй модели с дефицитом Smad3 (в которой экзон 2 удален) являются субфертильными [68], что позволяет предположить, что существующие модели с нокаутом Smad3 могут не полностью уничтожать белок SMAD3 и / или могут изменять функцию SMAD3 в различных формах. способами.Global Smad2 [69] и Smad4 [70, 71] нокаутные мыши погибают во время эмбрионального развития, что препятствует оценке роли SMAD2 или SMAD4 в фертильности в целом и синтезе FSH в частности. Были разработаны условные (floxed) аллели для Smad2 [72], Smad3 [73] и Smad4 [74–76], что должно позволить оценить их относительную роль в продукции ФСГ у гонадотрофов, по крайней мере, у мышей.
Как описано выше, промотор FSHB человека слабо отвечает на активины в клетках LβT2.Промотор овцы Fshb индуцируется активином А, но в меньшей степени, чем промоторы грызунов. Интересно, что канонический SBE длиной 8 пар оснований в промоторах мыши и крысы отсутствует как у человека, так и у овцы, что позволяет предположить, что дифференциальная реактивность активина промоторов разных видов может отражать присутствие / отсутствие этого цис- -элемента. В поддержку этой идеи введение SBE в промотор FSHB человека увеличивает его чувствительность к активину А, а также к сверхэкспрессируемым белкам SMAD [35, 77].Миллер и его коллеги предположили, что индукция активином промотора овец Fshb может быть независимой от SMAD [78]. Однако более свежие данные ставят под сомнение эту идею и вместо этого показывают роли как SMAD3, так и SMAD4 в регуляции активности промотора Fshb овец в клетках LβT2 [79]. Эти данные сходятся в поддержку гипотезы о том, что активины передают сигнал через канонический путь у гонадотрофов, чтобы регулировать транскрипцию Fshb , и что дифференциальное связывание SMAD, в частности, через 8-bp SBE, может объяснять межвидовые различия в чувствительности к активину.Однако, как однажды сказал Томас Хаксли: «Великая трагедия науки [состоит] в том, что прекрасная гипотеза опровергается уродливым фактом». В данном случае уродливый факт представился в виде свиньи.
История свиньи и лисы
Rhodes с коллегами сообщили, что свиной промотор Fshb , в котором отсутствует SBE длиной 8 п.н., сильно стимулируется активинами в клетках LβT2 [34]; действительно, даже в большей степени, чем мышиный промотор [32]. Поразительно, что промотор свиньи обладает высокой идентичностью последовательности с нечувствительным к активину человеческим FSHB .Систематическое сравнение промоторов человека и свиньи выявило одно различие п.н. между двумя видами, что, по-видимому, объясняет их дифференциальную чувствительность к активину [32]. Кроме того, анализ in silico выявил предполагаемый вилкообразный бокс (FOX) D1 цис -элемент, который включал этот bp (см. Жирный T в FBE2 на фиг. 1) у свиньи, но не в промоторе человека. Это было интригующим открытием, поскольку первым описанным ДНК-связывающим партнером для белков SMAD был другой член семейства боксов с вилкой, FOXh2 (ранее называвшийся FAST-1) [80, 81].В то время экспрессия FOXD1 в гонадотрофных клетках не была описана, но более ранняя работа Ellsworth et al. [82] показали избирательную экспрессию другого члена семейства, FOXL2, у гонадотрофов (и тиреотрофов). Более того, FOXL2 участвует в регуляции рецептора GnRH ( Gnrhr ) [83]. Учитывая сходство цис- -элементов между многими членами семейства вилкоголовых [84, 85], мы спросили, может ли FOXL2 по-разному связываться с промоторами человека и свиньи и каким-то образом опосредовать индукцию активина последнего.В самом деле, FOXL2 не только связывает предполагаемый элемент, связывающий головку вилки (FBE) в промоторе свиньи, более прочно, чем соответствующая последовательность в промоторе человека, но и замена расходящихся пар оснований между двумя видами полностью меняет их чувствительность к активину и связывание FOXL2. деятельность [32]. Кроме того, истощение эндогенного FOXL2 в клетках LβT2 нарушает индукцию активина промотора Fshb свиньи, тогда как эктопическая экспрессия FOXL2 придает чувствительность активину к промотору Fshb свиньи, не отвечающему в других отношениях, в гетерологичных клетках.В совокупности эти данные указывают на то, что стимуляция активином активности промотора Fshb свиньи зависит от FOXL2.
Foxl2 Регулирование транскрипции FSHB: только для свиней?
Важно отметить, что определенный FBE свиньи не только изменен в промоторе FSHB человека, но он аналогичным образом модифицирован в промоторах Fshb мыши, крысы и овцы, каждый из которых реагирует на активин в клетках LβT2. Это поставило вопрос о том, может ли регуляция FOXL2 активности промотора Fshb быть специфичной для свиней; то есть, так же, как SBE из 8 пар оснований является уникальным для промоторов Fshb грызунов, возможно, что идентифицированный FBE и, как следствие, FOXL2 могут быть важны только для индукции активином гена свиньи.Однако регуляция активности промотора Fshb мыши также оказалась чувствительной к FOXL2 [32, 62], предполагая, что белок может действовать через другой цис -элемент (или элементы). Мы идентифицировали альтернативный, более проксимальный FBE (FBE3 на рис. 1), который связывает FOXL2 и является критическим для индукции активином транскрипции мышиного Fshb [62]. Важно отметить, что этот элемент сохраняется у всех видов, включая крыс, свиней и людей. Таким образом, FOXL2, по-видимому, действует как общий регулятор транскрипции Fshb , но лежащие в основе его механизмы действия могут быть как консервативными, так и видоспецифичными.В соответствии с этой идеей Coss и др. Идентифицировали по крайней мере два дополнительных сайта связывания FOXL2 в проксимальном промоторе Fshb мыши [37], один из которых соответствует FBE2, а другой более удален от начала транскрипции (FBE1 на рис. 1). Из трех сайтов, FBE3, по-видимому, является наиболее важным для индукции активности промотора активином [62].
Закрытие связи между Activin Signaling и Foxl2
Если FOXL2 действительно опосредует регулируемую активином транскрипцию Fshb , как он связан с сигнальным каскадом активина? Ellsworth et al.продемонстрировали взаимодействие между SMAD3 и FOXL2 с использованием двугибридной системы млекопитающих [83]. Они также показали, что C-концевой домен Mad homology 2 (Mh3) SMAD3 и forkhead (ДНК-связывающий) домен FOXL2 являются критическими для этой ассоциации. Bilezikjian и его коллеги подтвердили эти наблюдения, используя анализ коиммунопреципитации в клетках HEK293, сверхэкспрессирующих эпитопно-меченные формы белков, и далее показали, что FOXL2 взаимодействует с SMAD3, но не с SMAD2 или SMAD4 [86] (см. Также [87]).Преимущественное взаимодействие между FOXL2 и SMAD3 несколько неожиданно, учитывая высокую консервативность последовательностей между SMAD2 и SMAD3, особенно внутри их доменов Mh3 (97% идентичности). Потребуется дополнительная работа, чтобы понять молекулярную основу этого предпочтительного взаимодействия. Тем не менее, эти данные помещают SMAD3 в качестве потенциального стержня между передачей сигналов активина и FOXL2.
Физическая ассоциация SMAD-FOXL2 дополняется их функциональной кооперативностью. SBE (AGAC или GTCT) расположены непосредственно рядом с двумя идентифицированными FBE в промоторе Fshb свиньи, и мутации в этих сайтах либо нарушают (сайт рядом с FBE3), либо полностью исключают (сайт рядом с FBE2; не показано на рис.1) индукция активином А или SMAD3 репортеров свиней как в гомологичных, так и в гетерологичных клетках [87]. И FOXL2, и SMAD3 должны обладать ДНК-связывающей активностью для стимуляции промотора Fshb свиньи . Эти данные предполагают механизм, посредством которого активины индуцируют накопление в ядре комплексов SMAD, которые связываются с FOXL2 (главным образом через SMAD3) и связываются с соседними SBE и FBE по крайней мере в двух местах в проксимальном промоторе свиньи. В настоящее время неясно, связывается ли FOXL2 конститутивно с этими элементами или он рекрутируется при передаче сигналов активина.Однако связывание SMAD3 (по крайней мере, с более дистальным SBE) требует предшествующей или скоординированной резидентности FOXL2 на промоторе [87].
Сходные, хотя и не идентичные механизмы, относятся к регуляции промотора Fshb мыши, у которого отсутствует более дистальный составной элемент SBE / FBE, наблюдаемый у свиней (FBE2 на фиг. 1). Возможно, в результате мутации SBE в более проксимальном составном элементе у мышей (SBE / FBE3 на рис. 1) являются значительно более разрушительными, чем у свиней [62, 87]. Примечательно, что они также более разрушительны, чем мутации в специфическом для грызунов 8-bp SBE [61, 62].Подобно свинью, промотор Fshb мыши может синергически регулироваться с помощью SMAD3 / 4 в комбинации с FOXL2 в гетерологичных клетках [62]. Однако, напротив, эта активность может быть дополнительно усилена коэкспрессией SMAD2, и SMAD3 не обязательно связывать ДНК напрямую, при условии, что SMAD4 сохраняет свою ДНК-связывающую активность. В совокупности эти данные подтверждают, что комплексы FOXL2 и SMAD кооперативно регулируют транскрипцию Fshb посредством композитных цис- -элементов.Однако относительные роли отдельных SMAD и сайтов связывания могут различаться у разных видов.
Роль Foxl2 в синтезе ФСГ in vivo
Хотя данные in vitro сильно указывают на участие FOXL2 в регуляции транскрипции Fshb , роль FOXL2 in vivo, если таковая имеется, до недавнего времени была неизвестна. Глобальная делеция единственного экзона гена Foxl2 у мышей вызывает как черепно-лицевые дефекты, так и нарушение нормального развития фолликулов яичников [88, 89].Билезикджян и его коллеги сообщили, что у этих животных также наблюдается дефицит ФСГ [90]. К сожалению, плохое здоровье и жизнеспособность мышей ограничили анализ сравнительно небольшим количеством животных, все из которых были пре- или периубертатными. Кроме того, у этих животных наблюдаются гипопластические гипофиза и дефекты выработки гормонов клеточными линиями, не экспрессирующими FOXL2. Следовательно, мыши Foxl2 — / — могут проявлять общее нарушение развития гипофиза, хотя это не исключает гонадотроп-специфических эффектов делеции гена на продукцию ФСГ.
Чтобы обойти эти мешающие факторы, мы генерировали мышей с нокаутом по гонадотрофам Foxl2 , используя стратегию Cre / loxP [91]. Эти животные становятся взрослыми, что позволяет полностью оценить их репродуктивную физиологию. Как мужские, так и женские условные нокауты (cKO) являются субфертильными. У самцов уменьшен размер семенников и количество сперматозоидов, тогда как у самок cKO яичники меньше с меньшим количеством желтых тел по сравнению с контрольной группой. Как мужские, так и женские cKO имеют пониженные уровни ФСГ в сыворотке и уровни мРНК Fshb в гипофизе, тогда как синтез мРНК Lhb кажется нормальным.Как базальная, так и стимулированная активином А экспрессия мРНК Fshb значительно снижена в первичных культурах гипофиза от животных cKO по сравнению с контролем. Это также относится к гипофизу мышей Foxl2 — / — [90]. В совокупности эти данные указывают на то, что FOXL2 является важным и селективным регулятором продукции ФСГ в клетках гонадотрофов in vivo. Более того, дефицит ФСГ у этих животных с нокаутом является результатом, по крайней мере частично, нарушения регуляции активина экспрессии Fshb .
Интересно, что в обеих моделях с нокаутом Foxl2 синтез ФСГ сильно нарушен, но не полностью отсутствует. В настоящее время механизмы, лежащие в основе остаточной экспрессии Fshb , неизвестны. Конечно, возможно, что не весь синтез ФСГ зависит от FOXL2. Поскольку мутации FBE в промоторе-репортерах Fshb более разрушительны для транскрипционной активности, чем истощение белка FOXL2 в клетках LβT2 [32, 62, 87], возможно, что другие белки вилки, особенно с аналогичной ДНК- Специфичность связывания и способность взаимодействовать с белками SMAD [43, 80, 81, 92–96] могут компенсировать потерю FOXL2.Тем не менее, данные in vivo ясно показывают, что любой такой компенсации недостаточно для поддержания количественно нормального производства ФСГ и фертильности.
Роль Foxl2 в синтезе человеческого ФСГ?
В настоящее время нерешенный вопрос заключается в том, регулирует ли FOXL2 транскрипцию человеческого FSHB , и если да, то как. Как указано выше, активины при введении сами по себе плохо стимулируют промотор-репортер FSHB человека в клетках LβT2. Однако активин A усиливает GnRH-стимулированную репортерную активность FSHB в этих клетках [97].Кроме того, несколько клинических наблюдений косвенно указывают на участие активинов в регуляции секреции ФСГ у людей (например, [98–105]). FOXL2 экспрессируется в гонадотрофах человека [106, 107] и может связываться по крайней мере с тремя элементами проксимального промотора FSHB человека [37]. Два из этих сайтов соответствуют FBE2 (слабое связывание) и FBE3 (сильное связывание). Третий сайт находится примерно на 220 п.н. выше сайта начала транскрипции и может быть специфичным для человека [37]. По нашему опыту, промотор-репортер FSHB человека слишком слабо стимулируется активинами или конститутивно активными рецепторами типа I, чтобы оценить функциональную роль этих элементов в клетках LβT2 [35].Однако Coss с коллегами показали, что мутации двух из этих сайтов значительно нарушают индукцию как активина A, так и конститутивно активного ALK7 человеческого промотора [37]. Они не исследовали роль FBE3. Хотя эти данные обнадеживают, необходимы дополнительные исследования, чтобы точно установить, регулирует ли FOXL2 FSHB человека и каким образом.
Более 100 различных мутаций FOXL2 (> 70% внутригенных) были зарегистрированы у пациентов с синдромом блефарофимоза, птоза и обратного эпиканта (ДПЭ), редкого аутосомно-доминантного заболевания, характеризующегося пороками развития век с (тип I) и без ( тип II) преждевременная недостаточность яичников (ПНЯ) [108–112].POF обычно ассоциируется с повышенным уровнем ФСГ в результате снижения отрицательной обратной связи по гормону яичников (например, [113, 114]). Насколько нам известно, сывороточные уровни ФСГ систематически не исследовались у женщин с BPES типа I; однако ФСГ имеет тенденцию повышаться в тех случаях, когда сообщалось об измерениях гормонов (например, [109, 115–121]). На первый взгляд это может означать, что FOXL2 незаменим для синтеза ФСГ у людей. Однако мы бы порекомендовали более детальную и осторожную интерпретацию имеющихся данных.
Потеря функции обоих аллелей Foxl2 необходима для значительного нарушения продукции ФСГ у мышей [91]. Однако большинство мутаций FOXL2 в случаях BPES являются гетерозиготными и редко связаны с явной дисфункцией гипофиза. Следовательно, гонадотрофы (и в частности промотор FSHB ) могут быть менее чувствительны к дозе гена FOXL2 , чем развивающиеся веки или яичники, которые, в свою очередь, проявляют дифференциальную чувствительность к изменениям в количестве или функции FOXL2 [122]; то есть, в то время как все патогенные мутации FOXL2 , по-видимому, вызывают пороки развития век, только те, которые окончательно нарушают экспрессию FOXL2, функцию активации trans и / или связывание ДНК (т.е. мутации с истинной потерей функции), которые приводят к дисфункции яичников, наблюдаемой при BPES типа I [123, 124]. Менее повреждающие мутации, включая некоторые замены аминокислот (как внутри, так и за пределами домена вилки) и расширения консервативного полиаланинового тракта (чаще всего от 14 до 24 остатков), по-видимому, вызывают более умеренные и специфичные для генов эффекты на FOXL2 trans. -функция активации. Хотя строгие взаимосвязи генотип-фенотип еще не установлены [125], существующие данные позволяют предложить континуум чувствительности, специфичной для конкретного органа или клетки, к вариантам FOXL2, при этом относительно легкие мутации вызывают черепно-лицевые дефекты, потерю функции в один аллель FOXL2 дополнительно вызывает ПОЯ (вероятно, яичникового происхождения), и, наконец, потеря функции обоих аллелей вызывает дефицит ФСГ (по крайней мере, у мышей).
К настоящему времени описано несколько гомозиготных мутаций в FOXL2 у людей. В одном случае [126] миссенс-мутация, E69K, заставляет FOXL2 формировать агрегаты в ядре, но существенно не изменяет функцию активации trans -активации белка (по крайней мере, на трех промоторах-репортерах) [124, 127]. В другом случае [120] расширение полиаланинового тракта с 14 до 19 остатков, которое не вызывает BPES у гетерозиготных носителей, приводит к умеренной цитоплазматической и ядерной агрегации мутантного белка и не нарушает функцию активации trans [ 128].Таким образом, идентифицированные до сих пор гомозиготные мутации не вызывают полной потери функции белка. В результате не существует человеческих случаев (пока описанных), аналогичных глобальным или условным моделям мышей с нокаутом Foxl2 . Гомозиготность мутаций потери функции в FOXL2 может потребоваться для наблюдения дефицита ФСГ у людей; однако такие мутации могут оказаться несовместимыми с жизнеспособностью, как в случае с большинством мышей Foxl2 — / — ([88–90] и наши неопубликованные наблюдения).
Перспективы на будущее
Открытие FOXL2 в качестве регулятора стимулируемого активином синтеза ФСГ представляет собой крупный прогресс в этой области, возможно, сравнимый по влиянию с случайным открытием роли раннего ответа 1 (EGR1) в продукции ЛГ, регулируемой ГнРГ [129]. Тем не менее, многие вопросы остаются без ответа, и ниже мы рассмотрим несколько примеров.
1) Хотя FOXL2 действует как медиатор передачи сигналов активина, может ли он играть более общую роль в гормональной регуляции экспрессии Fshb / FSHB ? В предварительном анализе мы не наблюдали эффектов мутаций FBE или нокдауна Foxl2 на GnRH-стимулированную активность промотора Fshb свиней или мышей в клетках LβT2 [32]; однако более свежие данные указывают на участие FOXL2 в стимулируемой прогестероном промоторной активности [77].В частности, мутации либо FBE1, либо FBE2 значительно нарушают независимую от прогестина (R5020) и синергетическую (с активином A) индукцию активности промотора мышиного Fshb . FBE3 (по крайней мере, как определено здесь) не исследовался. Более того, обе изоформы рецептора прогестерона, которые связаны с белками SMAD [56], взаимодействуют с FOXL2, а доминантно-отрицательная форма FOXL2 ингибирует индукцию R5020 активности промотора мышиного Fshb . Очевидно, что необходимы дополнительные исследования, чтобы установить полную степень роли FOXL2 в гормональной регуляции транскрипции Fshb .
2) Играет ли FOXL2 более общую роль в клеточно-специфической (базальной) экспрессии Fshb / FSHB? Гонадотроп-специфическая и регулируемая GnRH экспрессия субъединицы LHB / Lhb зависит от скоординированной активности общей (EGR1), органоспецифической ( парных -подобных гомеодоменных факторов транскрипции 1, PITX1) и клеточно-специфической ( SF1) факторов транскрипции [130]. Имеющиеся данные предполагают, что подобный комплекс может регулировать транскрипцию Fshb / FSHB , при этом FOXL2 функционирует в нем как ограничиваемый органом или клеткой компонент; то есть SF1, который участвует в синтезе FSH [131–133], может функционально и физически взаимодействовать с FOXL2 [134–137].PITX1 и PITX2 (изоформы; [138]) регулируют базальную и стимулируемую активином экспрессию FSHB / Fshb посредством консервативного цис- -элемента в проксимальном промоторе [33, 139–141] (см. Рис. 1). Насколько нам известно, функциональные и физические взаимодействия между белками FOXL2 и PITX не описаны, но примечательно, что, как и FOXL2, PITX1 и PITX2 взаимодействуют с SMAD3 [139, 141]. Кроме того, PITX2 может взаимодействовать с другим белком вилки, FOXC1 [142], обеспечивая прецедент для ассоциации между членами этих семейств белков.GATA2 также участвует в регуляции FSH in vivo [143], хотя его основной механизм действия неизвестен. Физические и / или функциональные взаимодействия FOXL2 с каждым из этих кандидатов-партнеров, а также с новыми белками, идентифицированными с помощью объективных скринингов [144, 145], требуют дальнейшего исследования. Такой анализ может предоставить необходимое понимание механизмов, ограничивающих экспрессию FSHB / Fshb гонадотрофами.
3) Как FOXL2 на самом деле регулирует активность промотора Fshb / FSHB ? Помимо связывания ДНК, в литературе мало данных, которые прямо касаются этой проблемы.Домены активации и репрессии транскрипции были картированы в др. Белках вилки (напр., [146–150]). Однако, учитывая отсутствие идентичности последовательностей среди членов семьи (за пределами ДНК-связывающего домена), неясно, как и если это влияет на наше понимание функции FOXL2. Поскольку FOXL2 может как активировать, так и репрессировать транскрипцию, в зависимости от гена-мишени (напр., [32, 82, 83, 86, 151–153]), необходимы более механистические анализы, чтобы определить, обладает ли белок врожденными доменами регуляции транскрипции.Некоторые белки вилки регулируют экспрессию генов-мишеней посредством прямого взаимодействия с TATA-связывающим белком (TBP) и родственными факторами [147, 154]. Поскольку Fshb / FSHB содержит консервативный ТАТА-бокс в пределах 30 п.н. от сайта начала транскрипции, ассоциация FOXL2 с базальным механизмом транскрипции заслуживает более тщательного изучения. Транскрипция связана с ремоделированием хроматина, если не зависит от нее, и известно, что белки вилки рекрутируют модифицирующие хроматин ферменты, включая гистоновые ацетилтрансферазы (HAT), к генам-мишеням (например,г., [155–158]). Взаимодействует ли FOXL2 аналогичным образом с HAT, такими как p300 или CBP, еще не определено; однако SMADs 2, 3 и 4 регулируют транскрипцию посредством рекрутирования этих и других HATs (напр., [159–163]). Следовательно, будет важно определить, рекрутирует ли FOXL2 HAT (или другие модификаторы гистонов) к промотору Fshb / FSHB либо отдельно, либо совместно с SMADs или другими кофакторами. В самом деле, за некоторыми исключениями (например, [164, 165]), как гормоны, сигнальные белки и факторы транскрипции эпигенетически регулируют локус Fshb / FSHB , фактически неизвестно и представляет собой плодородную почву для будущих исследований.
Таким образом, хотя активины были открыты как мощные регуляторы синтеза ФСГ более четверти века назад, только в последние несколько лет мы наконец получили истинное представление о лежащих в их основе механизмах. Недавнее открытие FOXL2 как критического медиатора регулируемой активином транскрипции Fshb должно послужить катализатором для более глубоких исследований. Результаты таких анализов обещают не только улучшить наше понимание клеточно-специфической и гормонально регулируемой экспрессии генов, но могут выявить новые цели для лечения бесплодия и других репродуктивных расстройств.
Благодарность
Авторы благодарят Беату Бак за отзыв о более ранней версии рукописи.
Список литературы
1.McCullagh
DR.
Двойная эндокринная активность яичек
.Наука
1932
;76
:19
—20
.2.Де Йонг
FH
,Шарп
РМ.
Доказательства ингибиноподобной активности в фолликулярной жидкости крупного рогатого скота
.Nature
1976
;263
:71
—72
.3.Schwartz
NB
,Channing
CP.
Доказательства наличия «ингибина» яичников: подавление вторичного повышения уровней сывороточного фолликулостимулирующего гормона у проэстральных крыс путем инъекции фолликулярной жидкости свиньи
.Proc Natl Acad Sci U S A
1977
;74
:5721
—5724
.4.Franchimont
P
,Chari
S
,Demoulin
A.
Взаимодействие гипоталамус-гипофиз-яички
.J Reprod Fertil
1975
;44
:335
—350
.5.Setchell
BP
,Jacks
F.
Ингибиноподобная активность в ретикулярной жидкости яичка
.J Endocrinol
1974
;62
:675
—676
.6.Нандини
SG
,Lipner
H
,Moudgal
NR.
Модельная система для изучения ингибина
.Эндокринология
1976
;98
:1460
—1465
.7.Frachimont
P
,Chari
S
,Hagelstein
MT
,Duraiswami
S.
Наличие в плазме фолликулостимулирующего гормона ингибирующего фактора
«бычьего» фактора.Nature
1975
;257
:402
—404
.8.Ling
N
,Ying
SY
,Ueno
N
,Esch
F
,Denoroy
L
,Isch
Guillemin
частичное характеристика белка Mr 32000 с ингибиторной активностью из фолликулярной жидкости свиньи.Proc Natl Acad Sci U S A
1985
;82
:7217
—7221
.9.Rivier
J
,Spiess
J
,McClintock
R
,Vaughan
J
,Purification
Vale W.
и частичная характеристика ингибина из фолликулярной жидкости свиньи
.Biochem Biophys Res Commun
1985
;133
:120
—127
.10.Робертсон
DM
,Фулдс
LM
,Leversha
L
,Morgan
FJ
,Hearn
MT
,000000000hall Burger
de Kretser
DM.
Выделение ингибина из фолликулярной жидкости крупного рогатого скота
.Biochem Biophys Res Commun
1985
;126
:220
—226
.11.Ling
N
,Ying
SY
,Ueno
N
,Shimasaki
S
,Esch
F
,9000 Guille4
Гипофизарный ФСГ высвобождается гетеродимером бета-субъединиц двух форм ингибина
.Nature
1986
;321
:779
—782
.12.Vale
W
,Rivier
J
,Vaughan
J
,McClintock
R
,Corrigan
A
,Woo
Woo
Spiess
J.
Очистка и характеристика белка, высвобождающего ФСГ, из фолликулярной жидкости яичников свиньи
.Nature
1986
;321
:776
—779
. 13.Abe
Y
,Minegishi
T
,Leung
шт.
Передача сигналов рецептора активина
.Факторы роста
2004
;22
:105
—110
. 14.Pangas
SA
,Woodruff
TK.
Пути передачи сигнала активина
.Trends Endocrinol Metab
2000
;11
:309
—314
.15.Льюис
KA
,Серый
PC
,Блаунт
AL
,MacConell
LA
,Wiater
E
,00040007
Bilezikjian 9M
Бетагликан связывает ингибин и может опосредовать функциональный антагонизм передачи сигналов активина
.Nature
2000
;404
:411
—414
. 16.Bernard
DJ
,Fortin
J
,Wang
Y
,Lamba
P.
Механизмы синтеза ФСГ: что мы знаем, чего не знаем и почему вам следует Уход
.Fertil Steril
2010
;93
(8)
:2465
—2485
. 17.Thackray
VG
,Mellon
PL
,Coss
D.
Гормоны в синергии: регуляция генов гонадотропинов гипофиза
.Mol Cell Endocrinol
2010
;314
:192
—203
0,18.Coss
D
,Mellon
PL
,Thackray
VGA.
FoxL в доме Smad: активиновая регуляция FSH
.Trends Endocrinol Metab
2010
;21
:562
—568
.19.Alarid
ET
,Windle
JJ
,Whyte
DB
,Mellon
PL.
Иммортализация клеток гипофиза на дискретных стадиях развития путем направленного онкогенеза у трансгенных мышей
.Девелопмент
1996
;122
:3319
—3329
.20.Graham
KE
,Nusser
KD
,Low
MJ.
Гонадотропные клетки LbetaT2 секретируют фолликулостимулирующий гормон (ФСГ) в ответ на активин А
.J Endocrinol
1999
;162
:R1
—R5
. 21.Weiss
J
,Guendner
MJ
,Halvorson
LM
,Jameson
JL.
Активация транскрипции гена бета-субъединицы фолликулостимулирующего гормона активином
.Эндокринология
1995
;136
:1885
—1891
.22.Weiss
J
,Crowley
WF
Jr ,,Halvorson
LM
,Jameson
JL.
Перифузия клеток гипофиза крысы с гонадотропин-рилизинг гормоном, активином и ингибином обнаруживает различные эффекты на экспрессию и секрецию гена гонадотропина
.Эндокринология
1993
;132
:2307
—2311
.23.Weiss
J
,Harris
PE
,Halvorson
LM
,Crowley
WF
Jr ,,Jameson
JL.
Динамическое регулирование уровней фолликулостимулирующего гормона-бета-мессенджера рибонуклеиновой кислоты активином и гонадотропин-рилизинг-гормоном в перифузированных клетках гипофиза крысы
.Эндокринология
1992
;131
:1403
—1408
.24.Attardi
B
,Winters
SJ.
Распад матричной РНК бета-фолликулостимулирующего гормона в присутствии ингибиторов транскрипции и / или ингибина, активина или фоллистатина
.Mol Endocrinol
1993
;7
:668
—680
0,25.Attardi
B
,Miklos
J.
Быстрое стимулирующее действие активина-A на информационную РНК, кодирующую бета-субъединицу фолликулостимулирующего гормона в культурах клеток гипофиза крыс
.Мол эндокринол
1990
;4
:721
—726
0,26.Carroll
RS
,Corrigan
AZ
,Vale
W
,Chin
WW.
Активин стабилизирует уровень фолликулостимулирующего гормона бета-мессенджера рибонуклеиновой кислоты
.Эндокринология
1991
;129
:1721
—1726
0,27.Corrigan
AZ
,Bilezikjian
LM
,Carroll
RS
,Bald
LN
,Schmelzer
CH
,J
,, Fendly
Подбородок
WW
,Schwall
RH
,Vale
W.
Доказательства аутокринной роли активина B в культурах передней доли гипофиза крыс
.Эндокринология
1991
;128
:1682
—1684
. 28.Pernasetti
F
,Васильев
VV
,Rosenberg
SB
,Bailey
JS
,Huang
HJ
M0007
M0007Клеточно-специфическая регуляция транскрипции фолликулостимулирующего гормона-бета активином и гонадотропин-рилизинг-гормоном в модели гонадотропных клеток гипофиза LbetaT2
.Эндокринология
2001
;142
:2284
—2295
. 29.Бернар
DJ.
И SMAD2, и SMAD3 опосредуют стимулируемую активином экспрессию бета-субъединицы фолликулостимулирующего гормона в гонадотропных клетках мыши
.Мол эндокринол
2004
;18
:606
—623
.30.Bailey
JS
,Rave-Harel
N
,McGillivray
SM
,Coss
D
,Mellon
PL.
Активиновая регуляция гена бета-субъединицы фолликулостимулирующего гормона включает Smads и белки гомеодомена TALE Pbx1 и Prep1
.Мол эндокринол
2004
;18
:1158
—1170
. 31.Грегори
SJ
,Lacza
CT
,Detz
AA
,Xu
S
,Petrillo
LA
,Kaiser
.Синергия между активином А и гонадотропин-рилизинг-гормоном при активации транскрипции гена бета-фолликулостимулирующего гормона крысы
.Мол эндокринол
2005
;19
:237
—254
.32.Ламба
P
,Fortin
J
,Tran
S
,Wang
Y
,Bernard
DJ.
Новая роль фактора транскрипции вилки FOXL2 в транскрипции бета-субъединицы фолликулостимулирующего гормона, регулируемой активином А
.Мол эндокринол
2009
;23
:1001
—1013
. 33.Suszko
MI
,Lo
DJ
,Suh
H
,Camper
SA
,Woodruff
TK.
Регулирование промотора бета-субъединицы фолликулостимулирующего гормона крысы активином
.Мол эндокринол
2003
;17
:318
—332
.34.West
BE
,Parker
GE
,Savage
JJ
,Kiratipranon
P
,Toomey
KS
Beach
,Шлюп
кВт
,Родос
SJ.
Регулирование гена фолликулостимулирующего гормона бета с помощью фактора транскрипции LHX3 LIM-гомеодомена
.Эндокринология
2004
;145
:4866
—4879
.35.Lamba
P
,Santos
MM
,Philips
DP
,Bernard
DJ.
Острая регуляция транскрипции бета-субъединицы фолликулостимулирующего гормона мышей с помощью активина A
.J Mol Endocrinol
2006
;36
:201
—220
0,36.Wang
Y
,Fortin
J
,Lamba
P
,Bonomi
M
,Persani
L
,Roberson
DJ
Активаторный белок-1 и белки smad синергетически регулируют активность бета-промотора фолликулостимулирующего гормона человека
.Эндокринология
2008
;149
(11)
:5577
—5591
0,37.Corpuz
PS
,Lindaman
LL
,Mellon
PL
,Coss
D.
FoxL2 требуется для индукции активина фолликулостимулирующего бета-субстрата мыши и человека.
.Мол эндокринол
2010
;24
:1037
—1051
0,38.Kumar
TR
,Schuff
KG
,Nusser
KD
,Low
MJ.
Гонадотроп-специфическая экспрессия гена бета-фолликулостимулирующего гормона человека у трансгенных мышей
.Mol Cell Endocrinol
2006
;247
:103
—115
.39.Dennler
S
,Huet
S
,Gauthier
JM.
Короткая аминокислотная последовательность в домене Mh2 отвечает за функциональные различия между Smad2 и Smad3
.Онкоген
1999
;18
:1643
—1648
.40.Dennler
S
,Itoh
S
,Vivien
D
,ten Dijke
P
,Huet
S
,Gauthier 9000.
Прямое связывание Smad3 и Smad4 с критическими бета-индуцируемыми элементами TGF в промоторе гена ингибитора активатора плазминогена человека типа 1
.EMBO J
1998
;17
:3091
—3100
.41.Jonk
LJ
,Itoh
S
,Heldin
CH
,ten Dijke
P
,Kruijer
W. ) в промоторе JunB, который действует как трансформирующий фактор роста-бета, активин и костный морфогенетический белок-индуцибельный энхансер
.J Biol Chem
1998
;273
:21145
—21152
.42.Shi
Y
,Wang
YF
,Jayaraman
L
,Yang
H
,Massague
J
,Pavlet4ich
.Кристаллическая структура домена Smad Mh2, связанного с ДНК: понимание связывания ДНК в передаче сигналов TGF-бета
.Cell
1998
;94
:585
—594
.43.Attisano
L
,Silvestri
C
,Izzi
L
,Labbe
E.
Транскрипционная роль Smads и FAST (Foxh20007) и activin.
Mol Cell Endocrinol
2001
;180
:3
—11
. 44.Аттисано
L
,Wrana
JL
,Cheifetz
S
,Massague
J.
Новые рецепторы активина: отдельные гены и альтернативный сплайсинг мРНК создают набор рецепторов серин / треонинкиназы
.Cell
1992
;68
:97
—108
. 45.Мэтьюз
LS
,Вейл
WW.
Экспрессионное клонирование рецептора активина, предсказанная трансмембранная серинкиназа
.Cell
1991
;65
:973
—982
.46. Мэтьюз
LS
,Вейл
WW
,Кинтнер
CR.
Клонирование второго типа рецептора активина и функциональная характеристика эмбрионов Xenopus
.Science
1992
;255
:1702
—1705
. 47.Мацук
MM
,Кумар
TR
,Bradley
A.
Различные фенотипы мышей с дефицитом активинов или рецепторов активина типа II
.Nature
1995
;374
:356
—360
. 48.Oh
SP
,Li
E.
Сигнальный путь, опосредованный рецептором активина типа IIB, контролирует формирование аксиального паттерна и латеральную асимметрию у мышей
.Genes Dev
1997
;11
:1812
—1826
. 49.Suszko
MI
,Woodruff
TK.
Клеточная специфичность реакции трансформирующего фактора роста бета определяется биодоступностью рецептора
.J Mol Endocrinol
2006
;36
:591
—600
.50.Lee
KB
,Khivansara
V
,Santos
MM
,Lamba
P
,Yuen
T
,Sealfon SC
, DJКостный морфогенетический белок 2 и активин А синергетически стимулируют транскрипцию бета-субъединицы фолликулостимулирующего гормона
.J Mol Endocrinol
2007
;38
:315
—330
. 51.Бернар
DJ
,Ли
КБ
,Сантос
ММ.
Активин B может передавать сигналы через ALK4 и ALK7 в гонадотропных клетках
.Репрод Биол Эндокринол
2006
;4
:52
.52.Tsuchida
K
,Nakatani
M
,Yamakawa
N
,Hashimoto
O
,Hasegawa
Y
через серин / треонинкиназу рецептора I типа ALK7.Mol Cell Endocrinol
2004
;220
:59
—65
. 53.Сандовал-Гусман
T
,Gongrich
C
,Moliner
A
,Guo
T
,Wu
H
, Broberger .Нейроэндокринный контроль репродуктивной функции женщин с помощью рецептора активина ALK7
.FASEB J
2012
;26
:4966
—4976
. 54.Gu
Z
,Nomura
M
,Simpson
BB
,Lei
H
,Feijen
A
van den Eijnden, van den Eijnden Рецептор активина типа I ActRIB необходим для организации яйцевого цилиндра и гаструляции у мышей
.Genes Dev
1998
;12
:844
—857
.55.Inman
GJ
,Nicolas
FJ
,Callahan
JF
,Harling
JD
,Gaster
LM
000000000 AD4000000 AD4000000 ReithHill
CS.
SB-431542 представляет собой мощный и специфический ингибитор рецепторов ALK4, ALK5 и ALK7
суперсемейства трансформирующего фактора роста-бета типа I рецептороподобной киназы активина (ALK).Mol Pharmacol
2002
;62
:65
—74
. 56.Thackray
VG
,Mellon
PL.
Синергетическая индукция экспрессии гена бета-субъединицы фолликулостимулирующего гормона рецепторами гонадных стероидных гормонов и белками Smad
.Эндокринология
2008
;149
:1091
—1102
. 57.Qiu
W
,Li
X
,Tang
H
,Huang
AS
,Пантелеев
AA
,Owens
Мыши с условным нокаутом рецептора активина типа 1B (Acvr1b) обнаруживают аномалию выпадения волос
.J Invest Dermatol
2011
;131
:1067
—1076
. 58.Ripoche
D
,Gout
J
,Pommier
RM
,Jaafar
R
,Zhang
CX
,Bartholin
Создание условной модели мыши для нацеливания на нарушение Acvr1b во взрослых тканях
.Genesis
2013
;51
(2)
:120
—127
. 59.Suszko
MI
,Balkin
DM
,Chen
Y
,Woodruff
TK.
Smad3 опосредует индуцированную активином транскрипцию гена бета-субъединицы фолликулостимулирующего гормона
.Мол эндокринол
2005
;19
:1849
—1858
.60.Zawel
L
,Dai
JL
,Buckhaults
P
,Zhou
S
,Kinzler
KW
,Vogelstein
Человеческие Smad3 и Smad4 являются активаторами транскрипции, специфичными для последовательности
.Mol Cell
1998
;1
:611
—617
.61.McGillivray
SM
,Thackray
VG
,Coss
D
,Mellon
PL.
Активин и глюкокортикоиды синергетически активируют экспрессию гена бета-субъединицы фолликулостимулирующего гормона в иммортализованной линии гонадотропных клеток LbetaT2
.Эндокринология
2007
;148
:762
—773
0,62.Tran
S
,Lamba
P
,Wang
Y
,Bernard
DJ.
SMAD и FOXL2 синергетически регулируют транскрипцию мышиного FSHbeta через консервативный проксимальный промоторный элемент
.Мол эндокринол
2011
;25
:1170
—1183
.63.Wang
Y
,Libasci
V
,Bernard
DJ.
Активин Для индукции транскрипции субъединицы FSHbeta требуется SMAD4 в иммортализованных гонадотропах
.Дж Мол Эндокринол
2010
;44
(6)
:349
—362
.64.Coss
D
,Thackray
VG
,Deng
CX
,Mellon
PL.
Активин регулирует экспрессию гена бета-субъединицы лютеинизирующего гормона через Smad-связывающие и гомеобоксовые элементы
.Мол эндокринол
2005
;19
:2610
—2623
0,65.Fortin
J
,Bernard
DJ.
SMAD3 и EGR1 физически и функционально взаимодействуют специфичным для промотора образом
.Cell Signal
2010
;22
:936
—943
0,66.Tomic
D
,Miller
KP
,Kenny
HA
,Woodruff
TK
,Hoyer
P
,Flaws
.Для развития фолликула яичника требуется Smad3
.Мол эндокринол
2004
;18
:2224
—2240
.67.Tomic
D
,Brodie
SG
,Deng
C
,Hickey
RJ
,Babus
JK
,000
Laws
MalkasMalkas
.Smad 3 может регулировать рост фолликулов в яичнике мыши
.Biol Reprod
2002
;66
:917
—923
0,68.Zhu
Y
,Richardson
JA
,Parada
LF
,Graff
JM.
У мутантных мышей Smad3 развивается метастатический колоректальный рак
.Cell
1998
;94
:703
—714
0,69.Waldrip
WR
,Bikoff
EK
,Hoodless
PA
,Wrana
JL
,Robertson
EJ.
Передача сигналов Smad2 во внеэмбриональных тканях определяет передне-заднюю полярность ранних эмбрионов мышей
.Cell
1998
;92
:797
—808
.70.Yang
X
,Li
C
,Xu
X
,Deng
C.
Proc Natl Acad Sci U S A
1998
;95
:3667
—3672
.71.Sirard
C
,de la Pompa
JL
,Elia
A
,Itie
A
,Mirtsos
C
,9000 S0004
000 S0004 Cheung,Wakeham
A
,Schwartz
L
,Kern
SE
,Rossant
J
,Mak
TW.
Ген-супрессор опухоли Smad4 / Dpc4 необходим для гаструляции, а затем и для переднего развития эмбриона мыши
.Genes Dev
1998
;12
:107
—119
.72.Liu
Y
,Festing
MH
,Hester
M
,Thompson
JC
,Weinstein
новинка M.
генообразование аллелей M.
.
Genesis
2004
;40
:118
—123
.73.Li
Q
,Pangas
SA
,Jorgez
CJ
,Graff
JM
,Weinstein
M
,Matzuk
.Избыточные роли SMAD2 и SMAD3 в клетках гранулезы яичников in vivo
.Mol Cell Biol
2008
;28
:7001
—7011
.74.Ян
X
,Li
C
,Herrera
PL
,Deng
CX.
Генерация мышей с условным нокаутом Smad4 / Dpc4
.Genesis
2002
;32
:80
—81
.75.Chu
GC
,Dunn
NR
,Anderson
DC
,Oxburgh
L
,Robertson
EJ.
Дифференциальные требования для Smad4 в TGFbeta-зависимом формировании паттерна раннего эмбриона мыши
.Девелопмент
2004
;131
:3501
—3512
.76.Bardeesy
N
,Cheng
KH
,Berger
JH
,Chu
GC
,Pahler
J
, Olson 9000 Pahler 9000 PahlerHorner
J
,Lauwers
GY
,Hanahan
D
,DePinho
RA.
Smad4 незаменим для нормального развития поджелудочной железы, но имеет решающее значение для прогрессирования и биологии опухоли рака поджелудочной железы
.Genes Dev
2006
;20
:3130
—3146
0,77.Ghochani
Y
,Saini
JK
,Mellon
PL
,Thackray
VG.
FOXL2 участвует в синергии между активином и прогестинами на промоторе
бета-субъединицы фолликулостимулирующего гормона.Эндокринология
2012
;153
:2023
—2033
0,78.Safwat
N
,Ninomiya-Tsuji
J
,Gore
AJ
,Miller
WL.
Бета-активированная киназа 1 трансформирующего фактора роста является ключевым медиатором экспрессии бета-субъединицы фолликулостимулирующего гормона овцы
.Эндокринология
2005
;146
:4814
—4824
.79.Wang
Y
,Bernard
DJ.
Активин Индукция бета-транскрипции фолликулостимулирующего гормона мышей и овец является SMAD-зависимой и TAK1 (MAP3K7) / p38 MAPK-независимой в гонадотропоподобных клетках
.Cell Signal
2012
;24
:1632
—1640
.80.Chen
X
,Rubock
MJ
,Whitman
M.
Транскрипционный партнер для белков MAD в передаче сигналов TGF-beta
.Nature
1996
;383
:691
—696
.81.Chen
X
,Weisberg
E
,Fridmacher
V
,Watanabe
M
,Naco
G
,Whitman
в сборке активин-чувствительный фактор.Nature
1997
;389
:85
—89
.82.Ellsworth
BS
,Egashira
N
,Haller
JL
,Butts
DL
,Cocquet
CMJ
,000
,Кемпер
SA.
FOXL2 в гипофизе: молекулярный, генетический анализ и анализ развития
.Мол эндокринол
2006
;20
:2796
—2805
.83.Ellsworth
BS
,Burns
AT
,Escudero
KW
,Duval
DL
,Nelson
SE
,000 Clay 9.
Последовательность, активирующая рецептор рилизинг-гормона гонадотропина (GnRH) (GRAS), представляет собой сложный регуляторный элемент, который взаимодействует с несколькими классами факторов транскрипции, включая Smads, AP-1 и ДНК-связывающий белок
вилки.Mol Cell Endocrinol
2003
;206
:93
—111
.84.Wijchers
PJ
,Burbach
JP
,Smidt
MP.
В ведении биологии: мышей, людей и лисиц
.Biochem J
2006
;397
:233
—246
0,85.Pierrou
S
,Hellqvist
M
,Samuelsson
L
,Enerback
S
,Carlsson
P.
Связывание белков, специфичных для сайта sevenhead и изгиб ДНК
.EMBO J
1994
;13
:5002
—5012
0,86.Blount
AL
,Schmidt
K
,Justice
NJ
,Vale
WW
,Fischer
WH
,Bilezikjian
L0007.FoxL2 и Smad3 координируют транскрипцию гена фоллистатина
.J Biol Chem
2009
;284
:7631
—7645
.87.Lamba
P
,Wang
Y
,Tran
S
,Ouspenskaia
T
,Libasci
V
MilGébert
Hebert
,Бернар
DJ.
Активин А регулирует транскрипцию бета-субъединицы фолликулостимулирующего гормона свиньи посредством кооперативного действия SMAD и FOXL2
.Эндокринология
2010
;151
:5456
—5467
.88.Schmidt
D
,Ovitt
CE
,Anlag
K
,Fehsenfeld
S
,Gredsted
L
, 9000 Trek9000 Trek
Фактор транскрипции крылатой спирали мышей Foxl2 необходим для дифференцировки гранулезных клеток и поддержания яичников
.Девелопмент
2004
;131
:933
—942
.89.Uda
M
,Ottolenghi
C
,Crisponi
L
,Garcia
JE
,Deiana
M
9000000000co,Cao
A
,Schlessinger
D
,Pilia
G.
Нарушение Foxl2 вызывает недостаточность яичников мыши из-за всепроникающей блокады развития фолликулов
.Hum Mol Genet
2004
;13
:1171
—1181
.90.Justice
NJ
,Blount
AL
,Pelosi
E
,Schlessinger
D
,Vale
W
,Bilezikjian
.Нарушение экспрессии FSHbeta в гипофизах мутантных животных Foxl2
.Мол эндокринол
2011
;25
:1404
—1415
.91.Tran
S
,Zhou
X
,Lafleur
C
,Calderon
M
,Ellsworth
BS
, Kimmins,Treier
M
,Boerboom
D
,Bernard
DJ.
Нарушение фертильности и синтеза ФСГ у гонадотроп-специфичных мышей Foxl2 , нокаут-мышей
.Мол эндокринол 2013
;27
(3)
:407
—421
0,92.Germain
S
,Howell
M
,Esslemont
GM
,Hill
CS.
Факторы транскрипции гомеодомена и крылатой спирали рекрутируют активированные Smads на отдельные промоторные элементы посредством общего мотива взаимодействия Smad
.Genes Dev
2000
;14
:435
—451
.93.Arden
KC.
FoxO: связывание новых сигнальных путей
.Mol Cell
2004
;14
:416
—418
.94.Seoane
J
,Le
HV
,Shen
L
,Anderson
SA
,Massague
J.
Интеграция нервных путей Smadheep и управления вилкой пролиферация клеток глиобластомы
.Cell
2004
;117
:211
—223
0,95.Randall
RA
,Howell
M
,Page
CS
,Daly
A
,Bates
PA
,Hill CS
.
Распознавание комплексов, содержащих фосфорилированный Smad2, по новому мотиву взаимодействия Smad
.Mol Cell Biol
2004
;24
:1106
—1121
.96.Gomis
RR
,Alarcon
C
,He
W
,Wang
Q
,Seoane
J
,9000 Lash
000 Группа синэкспрессии FoxO-Smadв кератиноцитах человека
.Proc Natl Acad Sci U S A
2006
;103
:12747
—12752
.97.Wang
Y
,Fortin
J
,Lamba
P
,Bonomi
M
,Persani
L
,Roberson
DJ
Активаторный белок-1 и белки smad синергетически регулируют активность бета-промотора фолликулостимулирующего гормона человека
.Эндокринология
2008
;149
:5577
—5591
.98.Lappohn
RE
,Burger
HG
,Bouma
J
,Bangah
M
,Krans
M.
опухолевый маркер клетки
Acta Obstet Gynecol Scand Suppl
1992
;155
:61
—65
.99.Ruckle
J
,Jacobs
M
,Kramer
W
,Pearsall
AE
,Kumar
R
h,,ra Underwood, Underwood
Ян
Y
,Condon
CH
,Sherman
ML.
Одноразовое рандомизированное двойное слепое плацебо-контролируемое исследование ACE-011 (ActRIIA-IgG1) у женщин в постменопаузе
.J Bone Miner Res
2009
;24
:744
—752
.100.Healy
DL
,Burger
HG
,Mamers
P
,Jobling
T
,Bangah
M
,Quinn
M
Day
AJ
,Rome
R
,Campbell
JJ.
Повышенные концентрации ингибина в сыворотке крови у женщин в постменопаузе с опухолями яичников
.N Engl J Med
1993
;329
:1539
—1542
.101.Кришнан
A
,Мердок
C
,Allard
J
,Cisar
M
,Reid
E
, 9000 Lieman0007Nieman
Псевдоизолированный дефицит ФСГ, вызванный гранулезно-клеточной опухолью, секретирующей ингибин B: клинический случай
.Hum Reprod
2003
;18
:502
—505
.102.Decoudier
B
,Hecart
AC
,Hoeffel
C
,Graesslin
O
,Joseph
K
,000 Fto4000 Demo7000000 Demon 9000 9000 Demo 9000 9000 DebtИзолированный дефицит ФСГ, выявляющий гранулезно-клеточную опухоль
.Ann Endocrinol (Париж)
2010
;71
:543
—547
.103.Welt
CK
,Hall
JE
,Adams
JM
,Taylor
AE.
Связь эстрадиола и ингибина с вариабельностью фолликулостимулирующего гормона при гипергонадотропном гипогонадизме или преждевременной недостаточности яичников
.J Clin Endocrinol Metab
2005
;90
:826
—830
.104.Welt
CK
,McNicholl
DJ
,Taylor
AE
,Hall
JE.
Репродуктивное старение женщин характеризуется пониженной секрецией димерного ингибина
.J Clin Endocrinol Metab
1999
;84
:105
—111
.105.Бургер
HG.
Доказательства роли отрицательной обратной связи ингибина в регуляции фолликулостимулирующего гормона у женщин
.Hum Reprod
1993
;8
(Дополнение 2)
:129
—132
.106.Чеснокова
V
,Zonis
S
,Wawrowsky
K
,Tani
Y
,Ben-Shlomo
A
ak4000ak4000A
,Банных
S
,Melmed
S.
Кластерин и FOXL2 действуют согласованно, регулируя рост гонадотропной аденомы гипофиза
.Мол эндокринол
2012
;26
:2092
—2103
.107.Egashira
N
,Takekoshi
S
,Takei
M
,Teramoto
A
,Osamura
RY.
Экспрессия FOXL2 в нормальных гипофизах человека и аденомах гипофиза
.Mod Pathol
2011
;24
:765
—773
.108.Beysen
D
,De Paepe
A
,De Baere
E.
Мутации FOXL2 и геномные перестройки в BPES
.Hum Mutat
2009
;30
:158
—169
.109.Crisponi
L
,Deiana
M
,Loi
A
,Chiappe
F
,Uda
M
,Porsche
isgliaZelante
L
,Nagaraja
R
,Porcu
S
,Ristaldi
MS
,Marzella
R
et al.Предполагаемый фактор транскрипции вилки FOXL2 мутирован при синдроме блефарофимоза / птоза / обратного эпиканта
.Nat Genet
2001
;27
:159
—166
.110.Verdin
H
,De Baere
E.
Нарушение FOXL2 при заболеваниях человека
.Horm Res Paediatr
2012
;77
:2
—11
.111.Stromme
P
,Sandboe
F.
Синдром обратного блефарофимоза-птоза-эпикантуса (BPES)
.Acta Ophthalmol Scand
1996
;74
:45
—47
.112.Beysen
D
,Vandesompele
J
,Messiaen
L
,De Paepe
A
,De Baere
E.
.
Hum Mutat
2004
;24
:189
—193
.113.Vagenakis
AG.
Эндокринные аспекты менопаузы
.Clin Rheumatol
1989
;8
(Дополнение 2)
:48
—51
.114.Анасти
JN.
Преждевременная недостаточность яичников: обновление
.Fertil Steril
1998
;70
:1
—15
.115.Raile
K
,Stobbe
H
,Trobs
RB
,Kiess
W
,Pfaffle
R.
Новая гетерозиготная мутация гена FOXL2 связана с большой кистой яичника и дисфункцией яичников у девочки-подростка с блефарофимозом / птозом / синдромом обратного эпиканта
.евро J Эндокринол
2005
;153
:353
—358
.116.Герсак
К
,Харрис
SE
,Смейл
WJ
,Артобстрел
AN.
Новая делеция 30 п.н. в гене FOXL2 у фенотипически нормальной женщины с первичной аменореей: история болезни
.Hum Reprod
2004
;19
:2767
—2770
.117.Ni
F
,Wen
Q
,Wang
B
,Zhou
S
,Wang
J
,Mu
Y
Cao
Y.
Анализ мутаций гена FOXL2 у китайских пациенток с преждевременной недостаточностью яичников
.Гинекол Эндокринол
2010
;26
:246
—249
.118.Amati
P
,Gasparini
P
,Zlotogora
J
,Zelante
L
,Chomel
JC
is
JC,,Bonneau
D.
Ген преждевременной недостаточности яичников, связанной с пороком развития века, отображается на хромосоме 3q22-q23
.Am J Hum Genet
1996
;58
:1089
—1092
.119.De Baere
E
,Beysen
D
,Oley
C
,Lorenz
B
,Cocquet
J
,De Sutter
De Sutter
K
,Dixon
M
,Fellous
M
,Fryns
JP
,Garza
A
,Jonsrud
C
и др.FOXL2 и BPES: горячие точки мутаций, фенотипическая изменчивость и пересмотр корреляции генотип-фенотип
.Am J Hum Genet
2003
;72
:478
—487
. 120.Nallathambi
J
,Moumne
L
,De Baere
E
,Beysen
D
,Usha
K
,Sundia
Новое расширение полиаланина в FOXL2: первое доказательство рецессивной формы синдрома блефарофимоза (BPES), связанной с дисфункцией яичников
.Hum Genet
2007
;121
:107
—112
.121.Beysen
D
,De Jaegere
S
,Amor
D
,Bouchard
P
,Christin-Maitre
Sineellou
,raus P,Grix
AW
,Hennekam
R
,Meire
F
,Oyen
N
,Wilson
LC
et al.Идентификация 34 новых и 56 известных мутаций FOXL2 у пациентов с синдромом блефарофимоза
.Hum Mutat
2008
;29
:E205
—E219
.122.Вентилятор
J
,Zhou
Y
,Huang
X
,Zhang
L
,Yao
Y
,Song
X
Hu
J
,Ge
S
,Song
H
,Вентилятор
X.
Комбинация мутации экспансии полиаланина и новой миссенс-замены в факторе транскрипции FOXL2 приводит к различным фенотипам яичников у пациентов с синдромом обратного блефарофимоза, птоза и обратного эпиканта (BPES)
.Hum Reprod
2012
;27
:3347
—3357
.123.De Baere
E
,Dixon
MJ
,Small
KW
,Jabs
EW
,Leroy
BP
,00070004 Devriendt4 ,Mortier
G
,Meire
F
,Van Maldergem
L
,Courtens
W
,Hjalgrim
H
et al.Спектр мутаций гена FOXL2 в семьях блефарофимоз-птоз-обратный эпикантус (BPES) демонстрирует корреляцию генотип-фенотип
.Hum Mol Genet
2001
;10
:1591
—1600
.124.Dipietromaria
A
,Benayoun
BA
,Todeschini
AL
,Соперники
I
,Bazin
C
,Veitia
На пути к функциональной классификации патогенных мутаций FOXL2 с использованием репортерных систем трансактивации
.Hum Mol Genet
2009
;18
:3324
—3333
.125.Haghighi
A
,Verdin
H
,Haghighi-Kakhki
H
,Piri
N
,Gohari
NS
, E. вне домена вилки FOXL2 вызывает тяжелую форму BPES типа II.Mol Vis
2012
;18
:211
—218
.126.Kaur
I
,Hussain
A
,Naik
MN
,Murthy
R
,Honavar
SG.
Спектр мутаций гена фактора транскрипции вилкообразной головки (FOXL2) у пациентов с синдромом обратного эпикантуса и птоза индийского блефарофимоза (BPES)
.Br J Офтальмол
2011
;95
:881
—886
.127.Beysen
D
,Moumne
L
,Veitia
R
,Peters
H
,Leroy
BP
,Deere
,De Paepe
E.
Миссенс-мутации в домене вилки FOXL2 приводят к субклеточной неправильной локализации, агрегации белков и нарушенной трансактивации
.Hum Mol Genet
2008
;17
:2030
—2038
.128.Moumne
L
,Dipietromaria
A
,Batista
F
,Kocer
A
,Fellous
M
x000 Veitromariax0004 Pail .Дифференциальная агрегация и функциональные нарушения, вызванные экспансией полиаланина в FOXL2, факторе транскрипции, участвующем в черепно-лицевом развитии и развитии яичников
.Hum Mol Genet
2008
;17
:1010
—1019
.129.Lee
SL
,Садовский
Y
,Swirnoff
AH
,Польский
JA
,Goda
P
,Gavrilina
Gavrilina
Gavrilina
Дефицит лютеинизирующего гормона и женское бесплодие у мышей, лишенных фактора транскрипции NGFI-A (Egr-1)
.Science
1996
;273
:1219
—1221
.130.Jorgensen
JS
,Quirk
CC
,Nilson
JH.
Множественные и перекрывающиеся комбинаторные коды управляют гормональной реакцией и диктуют клеточно-специфическую экспрессию генов, кодирующих лютеинизирующий гормон
.Endocr Ред.
2004
;25
:521
—542
.131.Jacobs
SB
,Coss
D
,McGillivray
SM
,Mellon
PL.
Ядерный фактор Y и стероидогенный фактор 1 физически и функционально взаимодействуют, способствуя клеточно-специфической экспрессии гена
фолликулостимулирующего гормона-бета мыши.Мол эндокринол
2003
;17
:1470
—1483
.132.Zhao
L
,Bakke
M
,Krimkevich
Y
,Cushman
LJ
,Parlow
AF
,Parker
Стероидогенный фактор 1 (SF1) необходим для функции гонадотропа гипофиза
.Девелопмент
2001
;128
:147
—154
.133.Zhao
L
,Bakke
M
,Parker
KL.
Гипофизарный нокаут стероидогенного фактора 1
.Mol Cell Endocrinol
2001
;185
:27
—32
.134.Park
M
,Shin
E
,Won
M
,Kim
JH
,Go
H
,Kim
HL4 9000 Ko7
HL4 9000 Ko
,Lee
K
,Bae
J.
FOXL2 взаимодействует со стероидогенным фактором-1 (SF-1) и подавляет SF-1-индуцированную транскрипцию CYP17 в клетках гранулезы
.Мол эндокринол
2010
;24
:1024
—1036
.135.Ян
WH
,Gutierrez
NM
,Wang
L
,Ellsworth
BS
,Wang
CM.
Синергетическая активация промотора Mc2r с помощью FOXL2 и NR5A1 у мышей
.Biol Reprod
2010
;83
:842
—851
.136.Fleming
NI
,Knower
KC
,Lazarus
KA
,Fuller
PJ
,Simpson
ER
,Clyne 9000.
Ароматаза является прямой мишенью FOXL2: C134W в опухолях гранулезных клеток через единственный высококонсервативный сайт связывания в специфическом для яичников промоторе
.PLoS One
2010
;5
:e14389
.137.Sridevi
P
,Chaitanya
RK
,Dutta-Gupta
A
,Senthilkumaran
B. промоторные мотивы
.Biochim Biophys Acta
2012
;1819
:57
—66
.138.Ламба
P
,Hjalt
TA
,Bernard
DJ.
Новые формы парноподобного гомеодоменного фактора транскрипции 2 (PITX2): генерация путем альтернативной инициации трансляции и сплайсинга мРНК
.БМК Мол Биол
2008
;9
:31
.139.Ламба
П
,Хивансара
В
,Д’Алессио
AC
,Сантос
MM
,Бернар
DJ.
Парные гомеодоменные факторы транскрипции 1 и 2 регулируют транскрипцию бета-субъединицы фолликулостимулирующего гормона через консервативный цис-элемент
.Эндокринология
2008
;149
:3095
—3108
.140.Zakaria
MM
,Jeong
KH
,Lacza
C
,Kaiser
UB.
Гомеобокс 1 гипофиза активирует ген крысиного FSHbeta (rFSHbeta) посредством как прямых, так и косвенных взаимодействий с промотором гена rFSHbeta
.Мол эндокринол
2002
;16
:1840
—1852
.141.Suszko
MI
,Antenos
M
,Balkin
DM
,Woodruff
TK.
Smad3 и Pitx2 взаимодействуют при стимуляции транскрипции гена FSHbeta
.Mol Cell Endocrinol
2008
;281
:27
—36
.142.Berry
FB
,линий
MA
,Oas
JM
,Footz
T
,Underhill
DA
,000
000
000 Wallet
000000
000
000Функциональные взаимодействия между FOXC1 и PITX2 лежат в основе чувствительности к дозе гена FOXC1 при синдроме Аксенфельда-Ригера и дисгенезе переднего сегмента
.Hum Mol Genet
2006
;15
:905
—919
.143.Чарльз
MA
,Saunders
TL
,Wood
WM
,Owens
K
,Parlow
AF
,R0007
Гордон
ДФ.
Гипофизарный нокаут Gata2: влияние на гонадотропную и тиреотропную функции
.Мол эндокринол
2006
;20
:1366
—1377
.144.Lee
K
,Pisarska
MD
,Ko
JJ
,Kang
Y
,Yoon
S
,Ryou
SMBae
J.
Транскрипционный фактор FOXL2 взаимодействует с DP103 и индуцирует апоптоз
.Biochem Biophys Res Commun
2005
;336
:876
—881
.145.L’Hote
D
,Georges
A
,Todeschini
AL
,Kim
JH
,Benayoun
BA,Bae
Bae
,Bae
.Открытие новых белков-партнеров фактора транскрипции FOXL2 дает представление о его физиопатологической роли
.Hum Mol Genet
2012
;21
:3264
—3274
.146.Qian
X
,Costa
RH.
Анализ доменов бета-белка ядерного фактора 3 гепатоцитов, необходимых для активации транскрипции и ядерного нацеливания
.Nucleic Acids Res
1995
;23
:1184
—1191
.147.Hellqvist
M
,Mahlapuu
M
,Blixt
A
,Enerback
S
,Carlsson
P.
Белок вилочной головки человека FREAC-2 содержит два функционально избыточных домена активации и взаимодействует с TBP и TFIIB
.J Biol Chem
1998
;273
:23335
—23343
.148.Берри
FB
,Saleem
RA
,Walter
MA.
Регуляция транскрипции FOXC1 опосредуется N- и C-концевыми доменами активации и содержит фосфорилированный домен ингибирования транскрипции
.J Biol Chem
2002
;277
:10292
—10297
.149.Wang
B
,Lin
D
,Li
C
,Tucker
P.
Множественные домены определяют экспрессию и регуляторные свойства транскрипционных репрессоров вилки Foxp1
.J Biol Chem
2003
;278
:24259
—24268
.150.Pani
L
,Overdier
DG
,Porcella
A
,Qian
X
,Lai
E
,Costa
Ядерный фактор гепатоцитов 3 бета содержит два домена активации транскрипции, один из которых является новым и консервативным с белком головки вилки дрозофилы
.Mol Cell Biol
1992
;12
:3723
—3732
.151.Pisarska
MD
,Bae
J
,Klein
C
,Hsueh
AJ.
Forkhead l2 экспрессируется в яичнике и подавляет промоторную активность стероидогенного острого регуляторного гена
.Эндокринология
2004
;145
:3424
—3433
.152.Бенци-Барнес
ИК
,Куо
FT
,Барлоу
GM
,Писарска
MD.
Человеческая вилка L2 репрессирует ключевые гены дифференцировки гранулезных клеток, включая ароматазу, P450scc и циклин D2
.Fertil Steril
2010
;94
:353
—356
.153.Kuo
FT
,Fan
K
,Bentsi-Barnes
I
,Barlow
GM
,Pisarska
MD.
Мышиная вилка L2 поддерживает репрессию ФСГ-зависимых генов в клетках гранулезы
.Репродукция
2012
;144
:485
—494
. 154.Wierstra
I
,Alves
J.
FOXM1c трансактивирует человеческий промотор c-myc напрямую через два TATA-бокса P1 и P2
.FEBS J
2006
;273
:4645
—4667
.155.Nasrin
N
,Ogg
S
,Cahill
CM
,Biggs
W
,Nui
S
,Dore
DoreJ
Ши
Y
,Рувкун
G
,Александер-Бриджес
MC.
DAF-16 привлекает коактиваторный комплекс CREB-связывающего белка к промотору белка 1 связывания инсулиноподобного фактора роста в клетках HepG2
.Proc Natl Acad Sci U S A
2000
;97
:10412
—10417
.156.Major
ML
,Lepe
R
,Costa
RH.
Для транскрипционной активности M1B Forkhead box требуется связывание комплексов Cdk-cyclin для зависимого от фосфорилирования рекрутирования коактиваторов p300 / CBP
.Mol Cell Biol
2004
;24
:2649
—2661
.157.Wang
F
,Marshall
CB
,Li
GY
,Yamamoto
K
,Mak
TW
, M. Распознавание промотора и рекрутирование коактиватора CBP / p300 с помощью FOXO3a.ACS Chem Biol
2009
;4
:1017
—1027
. 158.Wang
F
,Marshall
CB
,Yamamoto
K
,Li
GY
,Gasmi-Seabrook
GM
TW40004 Okada,Икура
М.
Структуры домена KIX CBP в комплексе с двумя доменами трансактивации FOXO3a обнаруживают неразборчивость и пластичность в рекрутировании коактиватора
.Proc Natl Acad Sci U S A
2012
;109
:6078
—6083
. 159.Feng
XH
,Zhang
Y
,Wu
RY
,Derynck
R.
Подавитель опухолей Smad4 / DPC4 и транскрипционный адаптер для smad4 / DPC4 и транскрипционный адаптер CBP / p300- бета-индуцированная активация транскрипции
.Genes Dev
1998
;12
:2153
—2163
.160.Janknecht
R
,Wells
NJ
,Hunter
T.
Стимулированное TGF-бета взаимодействие белков smad с коактиваторами CBP / p300
.Genes Dev
1998
;12
:2114
—2119
.161.Pouponnot
C
,Jayaraman
L
,Massague
J.
Физическое и функциональное взаимодействие SMAD и p300 / CBP
.J Biol Chem
1998
;273
:22865
—22868
.162.Wang
G
,Long
J
,Matsuura
I
,He
D
,Liu
F.
Линкерный домен Smad7.
Biochem J
2005
;386
:29
—34
.163.Itoh
S
,Ericsson
J
,Nishikawa
J
,Heldin
CH
,ten Dijke
P.
Сигнализация TGF-beta / Smad
.Nucleic Acids Res
2000
;28
:4291
—4298
. 164.Lim
S
,Luo
M
,Koh
M
,Yang
M
bin Abdul Kadir MN, Tan JH, Ye Z, Wang W, Melamed P.Определенные механизмы, включающие различные гистоновые деацетилазы, подавляют экспрессию двух генов бета-субъединиц гонадотропина у незрелых гонадотропов, и их действия преодолеваются гонадотропин-рилизинг-гормоном
.Mol Cell Biol
2007
;27
:4105
—4120
.165.Меламед
P
,Кадир
MN
,Wijeweera
A
,Seah
S.
Транскрипция бета-субъединиц гонадотропина взаимодействует между регуляторами транскрипции и перекрестно взаимодействует между ними. опосредуют действия регуляторных гормонов
.Mol Cell Endocrinol
2006
;252
:167
—183
.Заметки автора
© 2013 Общество изучения репродукции, Inc.
Определить роль ингибитора связывания рецептора ФСГ в регуляции развития фолликулов яичников и экспрессии ФСГР и ERα у мышей
Мышам из групп FRBI-1, FRBI-2 и FRBI-3 внутримышечно вводили 20, 30 и 40 мг / сут. кг соответственно в течение пяти дней подряд.Вес яичников трех групп FRBI был снижен по сравнению с группой FSH. Толщина коры яичников (ОКТ) в группе FRBI-3 была меньше, чем в группе ФСГ (P <0,05). По сравнению с группой ФСГ было меньше количества вторичных фолликулов (SF) и зрелых фолликулов (MF) в яичниках мышей, получавших FRBI, количество первичных фолликулов (PF) и SF также уменьшилось. У мышей FRBI-3 мы обнаружили, что примордиальных фолликулов (POF) было меньше, фолликулы развивались плохо, а клетки гранулезы становились апоптозными.Количество SF в группах FRBI-2 и FRBI-3 было меньше, чем в группе FSH на 20-й день (P <0,05). Максимальный продольный диаметр (MLD) и поперечный диаметр (MTD) трех групп FRBI во время эксперимента уменьшились. MLD и MTD в группе FRBI-3 были меньше, чем в группе FSH. Уровни мРНК и белка FSHR были ниже, чем у групп CG и FSH (P <0,05). Уровни белка ER α в группе FRBI и сывороточные концентрации ФСГ и эстрадиола (E 2 ) у мышей, получавших FRBI, были снижены по сравнению с группой CG и ФСГ.В заключение, лечение FSH может увеличить количество SF и MF, усилить развитие фолликулов, уменьшить количество SF и MF и подавить развитие фолликулов у мышей. Кроме того, FRBI снизил уровни мРНК и белка ER α и FSHR в яичниках и снизил сывороточные концентрации FSH и E 2 мышей.
1. Введение
Фолликулостимулирующий гормон (ФСГ) и эстрадиол (E 2 ) могут точно регулировать женскую фертильность в зависимости от развития фолликулов яичников и окончательной овуляции [1, 2].Взаимодействие между ФСГ и его родственным рецептором (ФСГР) активирует множественные сигнальные пути, ведущие к выработке стероидогенеза, который модулирует дифференцировку и пролиферацию клеток гранулезы яичника [3]. FSHR активирует киназы, регулируемые внеклеточными сигналами (ERK). Однако механизмы этих действий неизвестны [4].
Ингибитор связывания рецептора ФСГ (FRBI) блокировал комбинацию ФСГ с ФСГР и подавлял действие ФСГ на уровне гена и белка [5, 6]. In vivo введение FRBI приводило к подавлению овуляции и индуцированной фолликулярной атрезии у мышей [7] и влияло на фертильность у мартышек [8]. В последнее время появилось мало информации о влиянии FRBI на развитие фолликулов и репродуктивные функции у человека и животных [3, 9]. Точный механизм действия FRBI остается неясным [3, 10].
Эстроген регулирует фертильность человека и животных. Клеточные ответы на эстроген опосредуются рецептором эстрогена α (ER α ) и рецептором эстрогена β (ER β ) [11].
Связывание эстрогена с его рецепторами (ER) взаимодействует с элементами ядерного ответа на эстроген, что приводит к инициации транскрипции [12]. В моделях мышей и крыс нарушение ER α вызывает бесплодие как у мужчин, так и у женщин. Однако роль ER α и ER β в репродуктивной функции остается невыясненной [13]. На сегодняшний день остается неясным, влияет ли лечение FRBI на уровни экспрессии рецепторов эстрогена в фолликулах яичников [14, 15].
Настоящая работа была выполнена для оценки эффектов ингибитора связывания рецепторов ФСГ (FRBI) на развитие яичников и фолликулов и репродуктивных функций, для понимания механизма FRBI ингибирования взаимодействия ФСГ с ФСГР в фолликулах и для исследования сигнальная трансдукция и путь действия FRBI у мышей.
2. Материалы и методы
2.1. Получение ингибитора связывания рецептора ФСГ (FRBI)
Пептид ингибитора связывания рецептора ФСГ (FRBI) из 99.Чистота 9% была синтезирована и охарактеризована перед использованием в экспериментах. Приготовление ФРБИ проводили по методикам, установленным в нашей лаборатории [4, 8]. Концентрация FRBI составляла 1000 мк мкг / мл.
2.2. Лечение животных
150 самок мышей Kunming возрастом 21 день, массой тела 18,00 ± 1,23 г были приобретены в университете Ланьчжоу [лицензия № SCXK (Gansu) 2005-0007. Всех мышей случайным образом распределили на группу FRBI, группу FSH и контрольную группу (CG) (n = 30).FRBI 20, 30 и 40 мг / кг массы тела вводили внутримышечно мышам FRBI-1, FRBI-2 и FRBI-3, соответственно, в течение пяти дней подряд. 10 МЕ ФСГ вводили внутримышечно мышам группы ФСГ в течение пяти дней подряд. 0,2 мл физиологического раствора вводили мышам CG в течение пяти дней подряд. Уколы делали утром (с 8 до 9 утра) каждый день. Ссылаясь на нашу предыдущую процедуру [16], всех мышей выращивали в группе, держали в клетках для мышей и каждый день точно взвешивали с помощью электронных весов.
2.3. Сбор образцов и измерения
После того, как пяти мышам из каждой группы внутримышечно вводили 0,1 мг / кг ксилазина в дни 0, 7, 10, 15, 20 и 30 соответственно, они были убиты шейным смещением. Двусторонние яичники были вырезаны в асептических условиях с помощью острого скальпеля. Вес каждого яичника сразу взвешивали на электронных весах. Среднее значение было рассчитано на основе двусторонних яичников каждой мыши. Между тем, образцы крови собирали в дни 0, 7, 10, 15, 20 и 30 соответственно.Сыворотку отделяли и хранили при -20 ° C.
2.4. Гистологические наблюдения и измерение яичников и фолликулов
Яичники фиксировали в 10% формальдегиде, заливали парафиновым воском, затем нарезали ломтиками (5 мкм, мкм) и, наконец, окрашивали гематоксилином и эозином (H&E). Срезы просматривали под световым микроскопом (Leica, Япония). Обнаружены и подсчитаны вторичные фолликулы (диаметром 3-5 мм). Фотографировали микроскопические изображения яичников. Были измерены шесть сайтов в каждом разделе (5 разделов в каждой группе, всего 150 сайтов в каждой группе).Толщину коры яичника, максимальный поперечный диаметр (MTD) (MLD) и продольный диаметр каждого вторичного фолликула измеряли, соответственно, с помощью Pro Plus 2.0 (MOTIC Company, Гонконг, Китай).
2,5. ОТ-ПЦР в реальном времени (qRT-PCR) мРНК FSHR и ER
αУровни мРНК ER α и FSHR определяли с использованием количественной флуоресцентной ПЦР в реальном времени (qRT-PCR) и методов клонирования, чтобы оценить влияние FRBI на экспрессию мРНК ER α и FSHR в яичниках мышей.
2.5.1. Дизайн праймеров
Праймеры, специфичные для ER α (NM-001302531.1) и FSHR (инвентарный номер GenBank: NM-013523.3), были разработаны с помощью программного обеспечения Beacon Designer 7.0 (Premier Biosoft International, Пало-Альто, Калифорния, США) в соответствии с инструкциями производителя. руководящие принципы и Primer-BLAST в NCBI. Контрольным геном был ген GAPDH мыши (NM-008084.2, HM-043737.1), который использовали для нормализации уровней экспрессии генов-мишеней [17, 18]. Последовательности праймеров, используемых в кПЦР, были следующими: FSHR, прямой 5′-CGTCCTGATGAGCAAGTTTGG-3 ‘и обратный, 5′-TGGGCTGATTGACTTAGAGGG-3’; ER α , прямой 5′-CTTGTGTGTGGACACTCCGT-3 ‘и обратный 5′-AAGAAAGGCACAAGGCACGA-3′; GAPDH, прямой, 5’-CTTCAACAGCGACACTCACTCT-3 ‘и обратный, 5′-CCACCACCCTGTTGCTGTA-3’.
Оценивали концентрации праймеров (100 нМ, 200 нМ, 300 нМ и 500 нМ) и определяли образование димера праймера с использованием анализа кривой плавления. Концентрации праймера показали, что для дальнейшего эксперимента использовались только реакции без диммера.
2.5.2. Экстракция РНК и синтез кДНК
В соответствии с инструкциями производителя [17, 18] суммарную РНК экстрагировали из образцов яичников с использованием реагента Trizol (Invitrogen, Пекин, Китай).
кДНК синтезировали с помощью системы синтеза первой цепи superscript ™ для ПЦР с обратной транскрипцией (ОТ-ПЦР) (Invitrogen, Пекин, Китай).
2.5.3. Флуоресценция Количественная ОТ-ПЦР (кПЦР)
Уровни экспрессии мРНК ER α и FSHR определяли с помощью кПЦР на основе наших предыдущих методов [4, 17]. Относительный уровень каждой мРНК рассчитывали методом 2 -ΔΔ Ct и нормализовали по гену GAPDH на день 0. Образцы детектировали в трех повторностях.
2.6. Вестерн-блоты ER
α и FSHR белков в яичниках мышейВестерн-блоты проводили с использованием наших лабораторных методов [19]. Интегральная оптическая плотность (IOD) сканированных полос была достигнута с использованием программного обеспечения Quantity One (Bio-Rad Company, Hercules, CA, USA). Отрицательный контроль проводили без первичного антитела. Относительное содержание белков ER α и FSHR выражали как соотношение между значениями серого для белков ER α и FSHR, деленное на содержание β -актина.
2.7. Определение сывороточного ФСГ и E
2 КонцентрацииСывороточные концентрации эстрадиола (E 2 ) и ФСГ были обнаружены с помощью специальных наборов E 2 и FSH для мышей (ELISA) в соответствии с руководством по эксплуатации (Cusabio Biotech Co. , Ltd., Ухань, Китай) соответственно. Пределы обнаружения составляли 0,02 пг / мл для E 2 и 0,01 нг / мл для ФСГ. Коэффициенты вариации между и внутри эксперимента были менее 6% и 5%. Все образцы были протестированы в трех экземплярах.Подробные методы были описаны в нашем более раннем исследовании [17].
2,8. Статистический анализ данных
Для каждой группы все параметры (включая OCT, MLD, MTD, уровни ER β и FSHR, сывороточный E 2 и FSH) были рассчитаны на основе данных 5 мышей в каждой подгруппе. соответственно, с помощью SPSS v. 21.0 (SPSS Inc., Чикаго, Иллинойс, США). Данные выражены как среднее ± SEM. Данные для каждой временной точки анализировались отдельно. Все переменные пяти групп соответствовали предположениям одностороннего дисперсионного анализа.Дополнительные апостериорные тесты Тьюки были выполнены для определения попарных различий после выявления значимых различий. Уровень значимости был P <0,05.
3. Результаты
3.1. Вес яичников и толщина коры головного мозга мышей
Чтобы оценить влияние введения FRBI на развитие яичников, определяли вес яичников и толщину коры яичников (OCT), соответственно. По сравнению с контрольной группой (КГ). Вес яичников в группах FRBI был дозозависимо ниже, чем в группе, получавшей ФСГ (данные опущены).Но существенной разницы между группами не было.
Как показано на Рисунке 1, ОКТ группы ФСГ была немного увеличена по сравнению с КГ. OCT групп FRBI были снижены по сравнению с группой CG и FSH с минимальным значением группы FRBI-3. На 30-е сутки ОКТ в группе FRBI-3 было меньше, чем в группе ФСГ (P <0,05). Результаты показали, что высокая доза FBRI (40 мг / кг) может снизить ОКТ у мышей.
3.2. Гистологические структуры фолликулов
Чтобы определить влияние FRBI, регулирующего функцию ФСГ, на развитие фолликулов, структуру яичников наблюдали под микроскопом (× 100).Гистологические изменения на 20-е сутки были описаны во всех группах следующим образом.
3.2.1. Контрольная группа (CG)
Первичные фолликулы (POF) и первичные фолликулы (PF) были небольшими. Существовали несколько вторичных фолликулов (SF) и зрелых фолликулов (MF). Строение яичников и фолликулов завершено. Кора яичников и блестящая оболочка (ZP) были разными (рис. 2 (а)).
3.2.2. Группа ФСГ
Раздавались богатые СФ и МЖ. POF и PF стали больше, а числа SF явно увеличились по сравнению с CG (рис. 2 (б)).Фолликулярный антральный отдел сформирован в МЖ. Слои плотных гранулезных клеток распределены по SF. Фолликулы развиты полностью.
3.2.3. Группы FRBI
Яичники и фолликулы были полностью структурированы. Меньшее количество SF и MF существовало в яичниках по сравнению с группой FSH. Клетки гранулезы SFs расположены плотно (рис. 2 (с)). В группе ФРБИ-2 распределено несколько СФ и МФ. Уменьшены номера ПФ и ПФ. Zona pellucida (ZP) стала маленькой. Фолликулы развиты плохо. Было обнаружено, что клетки гранулезы стали апоптозными (рис. 2 (d)).POF были более редкими, чем у FRBI-3. Наблюдались редкие SF и MF по сравнению с группами FSH и CG. Фолликулы развиты плохо. Апоптоз гранулезных клеток наблюдался в группе FRBI-3 (рис. 2 (е)).
Эти результаты продемонстрировали, что лечение ФСГ может увеличивать количество SF и MF, тем самым улучшая развитие фолликулов. Введение FRBI уменьшало количество SF и MF и, следовательно, подавляло развитие фолликулов.
3.3. Количество вторичных фолликулов у мышей
Данные в таблице 1 показали, что количество вторичных фолликулов в группе ФСГ было больше, чем в группе ХГ во время эксперимента, с самым высоким приростом, обнаруженным на 20-й день (P <0.01). Однако количество фолликулов в группах FRBI было уменьшено с 7 дня по сравнению с группой CG и FSH. На 20-й день количество фолликулов в трех группах FRBI было меньше, чем в группе FSH (P <0,01). Кроме того, количество фолликулов в группе FRBI-3 было ниже, чем CG на 15, 20 и 30 дни. Результаты показали, что ФСГ способствует развитию фолликулов. Введение FRBI уменьшало количество вторичных фолликулов и подавляло фолликулярное развитие мышей.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

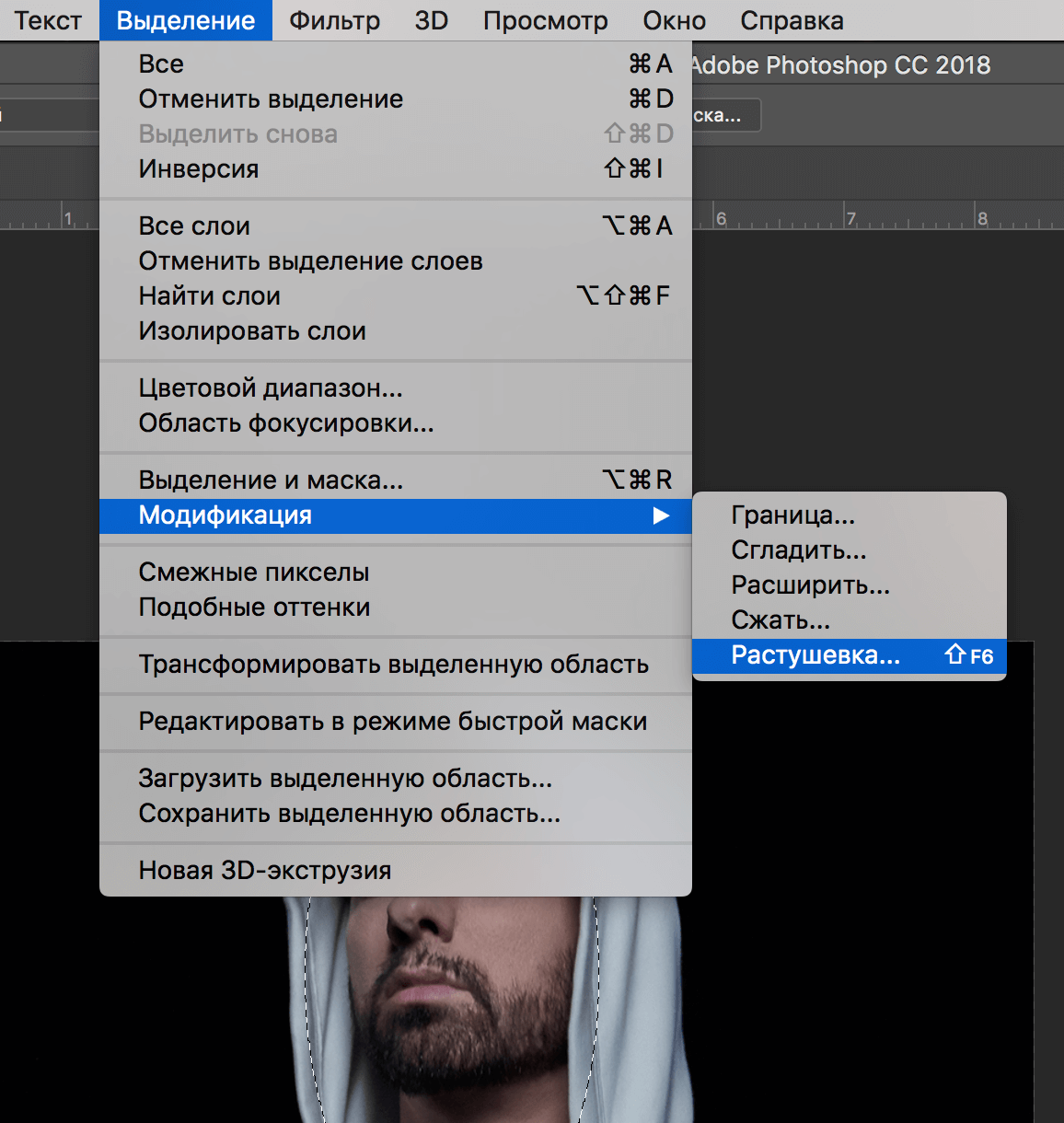 Иногда это окошко или вкладка отключены, включить отображение можно через настройки меню рабочей области.
Иногда это окошко или вкладка отключены, включить отображение можно через настройки меню рабочей области.